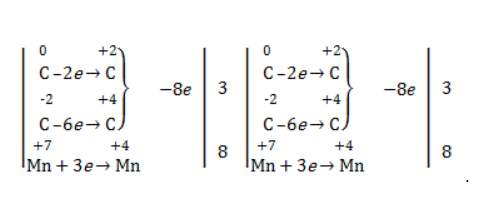- Братья! Контрольная работа, через 2 часа сдавать! Помогите! 4. Сумма коэффициентов в уравнении окисления этанола подкисленным раствором перманганата калия равна:
- Замечания, решения и ответы второму заданию
- Acetyl
- Окисление алкенов перманганатом калия
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- 🔍 Видео
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Братья! Контрольная работа, через 2 часа сдавать! Помогите!
4. Сумма коэффициентов в уравнении окисления этанола подкисленным раствором перманганата калия равна:
5. Аминокислоты могут иметь свойства:
А) только основные
Б) только кислотные
В) и основные, и кислотные
Г) не имеют ни основных, ни кислотных свойств
6. Формуле
соответствует название:
А) 1-амино-4-этилпентановая кислота;
Б) 1-амино-4-метилгексановая кислота;
В) 3- амино-4-этилпентановая кислота;
Г) 3-амино-4-метилгексановая кислота
7. Тип химической реакции, к которому относится взаимодействие аминокислот друг с другом
А) полимеризация
Б) поликонденсация
В) дегидрирование
Г) этерификация
8.Установите соответствие между формулой вещества и классом соединения:
Формула Класс
1. глицин А) спирты
2. этилформиат Б) аминокислоты
3. анилин В) сложные эфиры
4. ацетон Г) углеводы
5.С12Н22О11 Д) амины
9. Решите цепочку.
С2Н2 → С6Н6 → С6Н5NO2 → С6Н5NH2
Дай названия продуктам реакции (органическим веществам).
10. Вычисли массу бромной воды с массовой долей брома 2%, которая потребуется для полного взаимодействия со 186 г 1%-го раствора анилина.
11. Строение соединения с молекулярной массой 74, содержащего 48,7 % углерода, 8,1 % водорода и 43,2 % кислорода, взаимодействующего с раствором гидроксида калия и дающего реакцию на лакмус.
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Замечания, решения и ответы второму заданию
Замечания, решения и ответы второму заданию
I. Замечания технического характера
Не забывайте указывать свою фамилию на листах документа с ответами. Называйте файл с ответами своей фамилией.
II. Анализ решений и ответы
Задание 1. Определите усредненную степень окисления атомов углерода алгебраическим методом и степень окисления каждого атома углерода графическим методом в следующих соединениях: 2-аминопропан, глицерин, 1,2 – дихлорпропан, аланин, метилфенилкетон.
Допущенные ошибки: 1) неправильно составлена структурная или молекулярная формулы вещества; 2) допущены арифметические ошибки в расчете усредненной степени окисления; 3) некоторые участники мастер-класса нашли либо усредненную степень окисления алгебраически, либо индивидуальную степень окисления графическим способом, то есть выполнили задание частично.
В этом задании можно было проверить правильность вычисления усредненной степени окисления так: сложить все индивидуальные степени окисления атомов углерода и разделить сумму на число атомов углерода.
Правильное выполнение этого задания привожу из работы Натальи Валерьевны Ушаковой:
Задание 2. Составьте уравнения реакций:
1) горения стеариновой кислоты в кислороде;
2) полного окисления глюкозы концентрированной азотной кислотой.
Используя усредненную степень окисления углерода, составьте электронный баланс и расставьте коэффициенты
Допущенные ошибки: 1) неправильно составлена формула органического вещества; 2) допущены арифметические ошибки в расчете усредненной степени окисления углерода; 3) допущены ошибки в вычислении числа отданных углеродом электронов; 4) неправильно определены продукты реакции. Это связано, по всей видимости, с невнимательным прочтением пояснений и задания. Полное окисление идет до образования углекислого газа. В некоторых работах в качестве продукта восстановления концентрированной азотной кислоты указан оксид азота (II) и даже азот; 5) в некоторых работах в балансе не учтен индекс при углероде; 6) некоторые участники мастер-класса использовали не усредненную степень окисления в стеариновой кислоте, а индивидуальные степени окисления, что не соответствует заданию.
Правильное решение (из работы ):
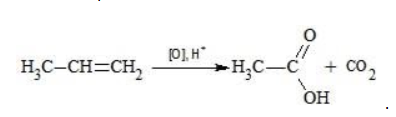
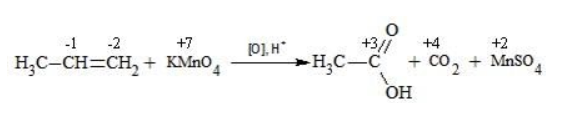
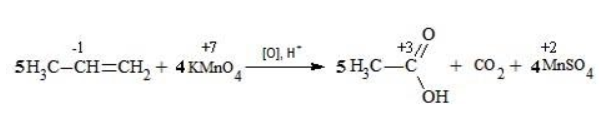
1) Составьте уравнение реакции окисления этанола подкисленным раствором перманганата калия при нагревании с образованием уксусного альдегида.
2) Составьте уравнение реакции окисления толуола подкисленным раствором перманганата калия при нагревании с образованием бензойной кислоты.
В электронном балансе используйте степени окисления только тех атомов углерода, которые меняют степень окисления.
Допущенные ошибки: 1) в некоторых работах неправильно составлены формулы исходных веществ и продуктов; 2) в балансе используются степени окисления атомов, которые не участвовали в реакции; 3)найденные в балансе коэффициенты не перенесены в уравнение или перенесены неправильно.
Правильное решение (из работы ):
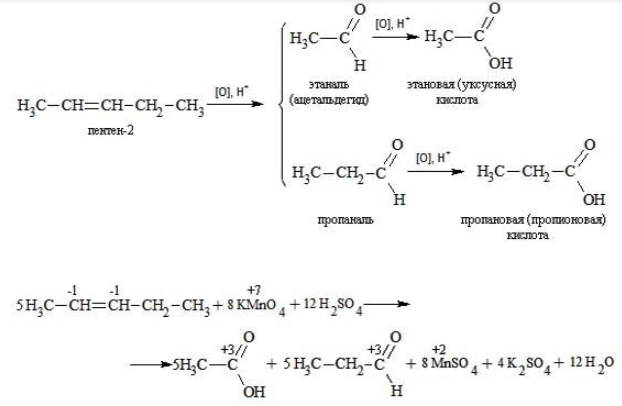
1) Составьте уравнение реакции деструктивного окисления по обеим двойным связям 4-метилпентадиена – 1,3 подкисленным раствором перманганата калия при нагревании.
Ошибки: Во многих работах неправильно определен один из продуктов – вместо щавелевой кислоты – уксусная. Встречались ошибки и в составлении формулы исходного вещества. Некоторые участники мастер-класса не обратили внимание на то, что окисление деструктивное и пытались сохранить углеродную цепь в продуктах.
2) Составьте уравнение реакции окисления стирола водным раствором перманганата калия при нагревании.
Ошибки: многие решили, что получится двухатомный спирт. Это неверно, так как реакция Вагнера идет без нагревания, а в условиях нашего задания нагревание указано. Многие забыли, что в нейтральной среде получаются не кислоты, а соли, углекислый газ превращается в гидрокарбонат или карбонат. Некоторые не учли, что гидрокарбонат и щелочь в продуктах одновременно существовать не могут, происходит нейтрализация гидрокарбоната.
3) Составьте уравнение реакции окисления 1-изопропил-3-метил-2-пропил-5-этилбензола щелочным раствором перманганата калия при нагревании.
Ошибки: В некоторых работах среди продуктов обнаружился углекислый газ и карбоновые кислоты, хотя в щелочной среде однозначно получаются соли карбоновых кислот, углекислый газ превращается в карбонат. Некоторые в качестве продукта указали формиат (в приведенных условиях он окисляется до карбоната). Были работы, в которых оказались неучтенными некоторые атомы углерода, изменившие степень окисления, допущены арифметические ошибки – неправильно определена сумма отданных углеродом электронов.
Решение 1 пункта задания 4 взято из работы Татьяны Леонидовны Быковой:



2С-1 – 8е ® 2С+3 16е 5 восстановитель
Mn+7 + 5е ® Mn+2 16 окислитель
С0 + 2С-1+ С-2 – 16е ® С+2 + 2С+3 + С+4
Решения 2 и 3 пункта задания 4 взяты из работы Нелли Ивановны Ариновой:
2) С6Н5 – С-1Н=С-2Н2 +KMn+7O4+H2O® С6Н5 – С+3ООK + Mn+4O2 + KOH+KHС+4 O3

С -2 – 6е ® С+4 — 10 е 3 восстановитель
Mn+7 + 3е ® Mn+4 10 окислитель
Ставим коэффициенты перед углеродом и марганцем, уравниваем калий:
3С6Н5 – СН=СН2 +10KMnO4+H2O® 3С6Н5 – СООK + 10MnO2 + 4KOH+3KHСO3
Учитывая то, что кислая соль нейтрализуется щелочью:
4KOH+ 3КНСО3 ® 3К2СО3 + КOH + 3H2O изменим продукты реакции:
3С6Н5 – СН=СН2 +10KMnO4+H2O® 3С6Н5 – СООK + 10MnO2 + 3К2СО3+ KOH
Проверим число атомов водорода в правой части уравнения – 16, в левой части – 24 без учета воды, следовательно, воду нужно перенести в правую часть:
3С6Н5 – СН=СН2 +10KMnO4 ® 3С6Н5 – СООK + 10MnO2 + 3К2СО3+ KOH + 4H2O












3С-3 – 21е ®3С+4 46 1 восстановитель
Mn+7 + 1е ® Mn+6 46 окислитель
С15Н30 +46KMnO4 + 57KOH® С10Н8О8К4 + 3К2СО3 + СН3–СООK+ 46K2MnO4 +38H2O
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать  Окисление алкенов перманганатом калияВ отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия. Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать  Понятие о неполном окисленииВ химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением. Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества. Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая Определение степеней окисленияДля того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов. Например, при окислении пропена перманганатом калия
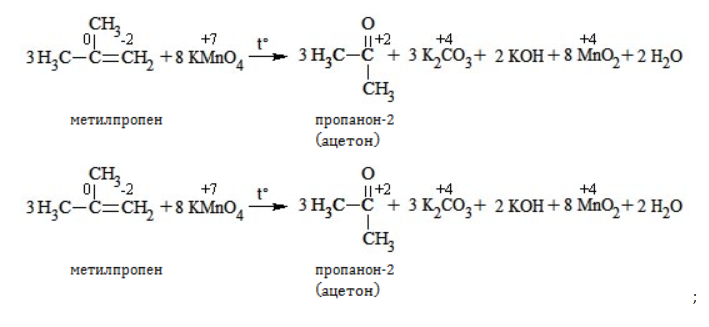
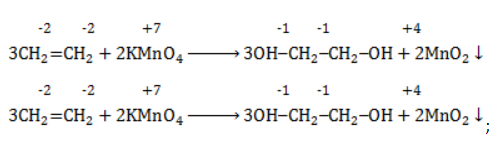
В общем виде результат можно записать следующим образом: Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода. Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать  Влияние среды на окислительСостав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково. Неорганическая соль В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4: Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи. Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2: При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6: Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать  Мягкое окислениеПроцесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля: Для составления полного уравнения нужно:
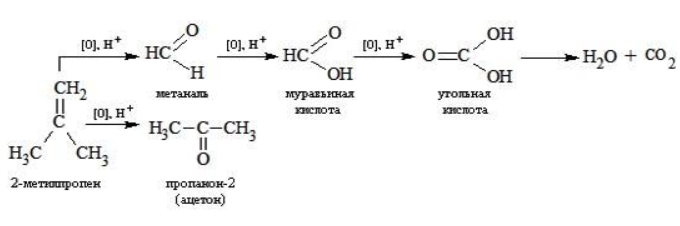
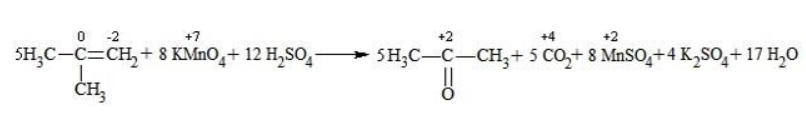
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично: Дальше мягкое окисление не идет, так как Видео:Самый легкий способ уравнять ОВР в органике!Скачать  Жесткое окислениеЖесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли. Окисление перманганатом калия в кислой средеПропен в содержащем кислоту растворе Степени окисления участвующих в реакции углеродных атомов и марганца составят: Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты: Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления: Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты: Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот: Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями. Правило, по которому осуществляется окисление углерода, отражено в таблице: Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона: Окисление алкенов в щелочной средеПри нагревании с концентрированной щелочью алкены окисляются до солей: Если один из углеродных атомов – первичный, он окисляется до углекислого газа: Окисление в нейтральном раствореВ условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон: Видео:Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать  ЗаключениеВзаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов. 🔍 ВидеоРЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Обезвреживание ксенобиотиков. Механизм развития толерантности. Обезвреживание этанола. КанцерогенезСкачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать  140. Расставляем коэффициенты методом электронного балансаСкачать  21 11 18 Вебинар Окислительно восстановительные реакции в органической химииСкачать  25. Схема реакции и химическое уравнениеСкачать  Как составлять органические ОВР? Основы окисления органики | Химия ЕГЭ 2022 | УмскулСкачать  Окисление в органике: кислородсодержащие соединения | Химия ЕГЭ 2022 | УмскулСкачать  Окислительно-восстановительные реакции в органической химии. Метод электронного баланса.Скачать  Уравнивание органических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 4 из 4.Скачать  |






















 -связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.
-связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.

 вступающий в реакцию пропен
вступающий в реакцию пропен 
 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей 



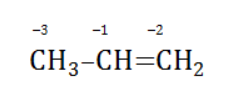

 в водном растворе диссоциирует на катион металла
в водном растворе диссоциирует на катион металла  и собственно окислитель – перманганат-анион
и собственно окислитель – перманганат-анион  . В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.
. В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.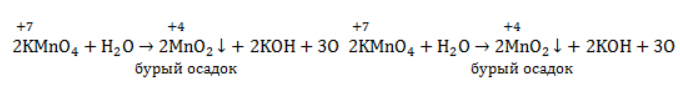
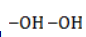 . Источниками их формирования служат:
. Источниками их формирования служат: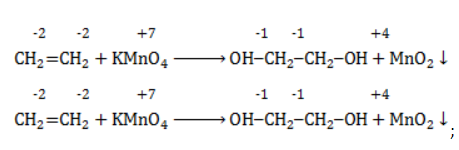

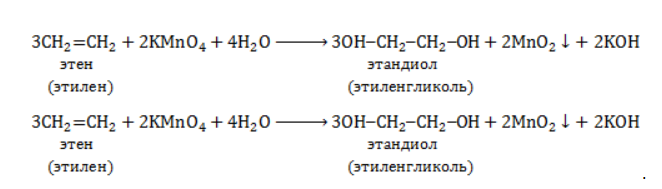
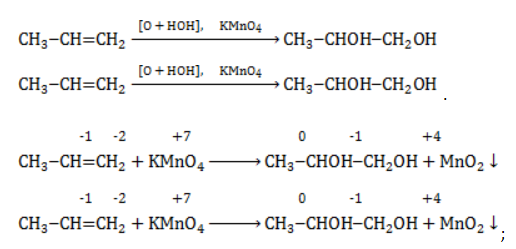
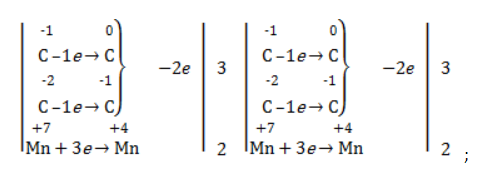
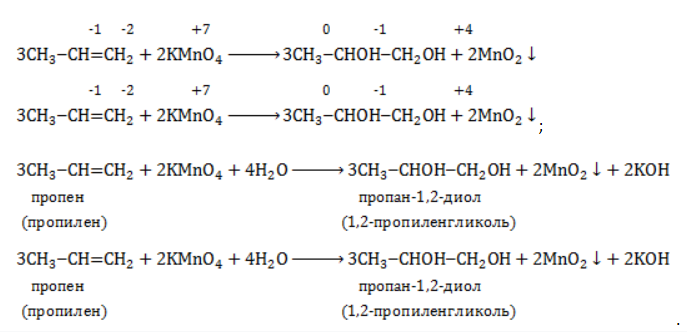
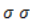 -связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
-связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
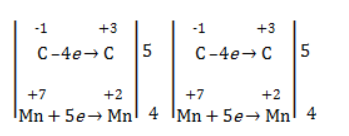


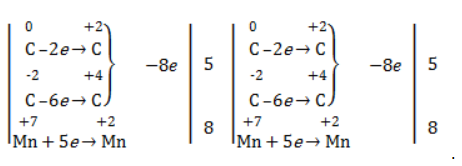

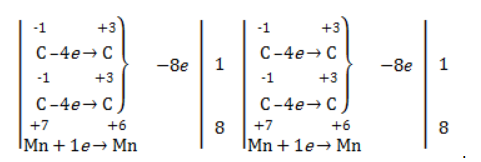




 .
.