- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Все химические реакции можно разделить на два типа (стр. 4 )
- В молекулярном уравнении реакции Ва + Н2SО4 = ВаSО4 + Н2О + Н2S Сумма всех коэффициентов?
- Сумма коэффициентов в сокращенном ионно — молекулярном уравнении реакции между сероводородной кислотой и гидроксидом натрия равна?
- Сумма коэффициентов в молекулярном уравнении реакции : С2Н12 + О2 = СО2 + Н2О?
- Укажите суммы всех коэффициентов в молекулярном, полном ионно — молекулярном и кратком ионно — молекулярном уравнениях реакции гидроксида калия с сероводородной кислотой, приводящей к образованию суль?
- Закончите уравнение реакции в молекулярной форме и подсчитайте сумму стехиометрических коэффициентов :H2C2O4 + MnO4 + H = ?
- Сумма коэффициентов в молекулярном уравнении реакции C5H12 + O2 = CO2 + H2O?
- Помогите пожалуйста срочно прошу вас Написать молекулярное и ионное уравнения реакций?
- Чему равна сумма коэффициентов в кратком ионно — молекулярном уравнении реакции между гидрокарбонатом натрия и раствором соляной кислоты?
- Сумма всех коэффициентов в молекулярном уравнении реакции, схема которой ВаО + Нз Р04 = Ва3 (Р04)2 + ?
- Закончить молекулярное уравнение и написать полные и краткие ионные уравнения реакций взаимодействия следующих веществ : Fe(OH)3 + HBr → ?
- 🎬 Видео
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Все химические реакции можно разделить на два типа (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Используем теперь метод электронно-ионного баланса. Рассмотрим полуреакцию окисления. Молекула FеS2 превращается в ион Fе3+ (Fе(NО3)3 полностью диссоциирует на ионы) и два иона SO42- (диссоциация H2SO4):
FeS2 → Fe3+ + 2SO24-.
Для того, чтобы уравнять кислород, в левую часть, добавим 8 молекул H2O, а в правую – 16 ионов Н+ (среда кислая!):
FeS2 + 8H2O → Fe3+ + 2SO42- + 16H+.
Заряд левой части равен 0, заряд правой +15, поэтому FеS2 должен отдать 15 электронов:
FеS2 + 8Н2О — 15е → Fе3+ + 2SО42- + 16Н+.
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
Необходимо отнять у NО3- один атом О. Для этого к левой части добавим 2 иона Н+ (кислая среда), а к правой — одну молекулу Н2О:
NО3- + 2Н+ → NО2 + Н2О.
Для уравнивания заряда к левой части (заряд +1) добавим один электрон:
NО3- + 2Н+ + е → NO2 + Н2О.
Полный электронно-ионный баланс имеет вид:
Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
FеS2 + 15NО3- + 14Н+ = Fе3+ + 2SО42- + 15NО2 + 7Н2О.
Добавив в обе части уравнения соответствующее количество ионов по три иона NО3- и Н+, находим молекулярное уравнение реакции:
FеS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Задача 2. Напишите уравнения реакций, протекающих в водной среде:
а) Na2SО3 + КМnО4 + Н2SО4 → X + …
а) Перманганат калия в кислой среде восстанавливается в соль марганца (II), а сульфит натрия окисляется до сульфата натрия:
5Nа2SО3 + 2КМnО4 + ЗН2SО4 = 5Nа2SО4 + К2SО4 + 2МnSО4 + ЗН2О.
б) Из продуктов реакции а) только сульфат марганца (II) (вещество X) реагирует со щелочью в водном растворе:
MnSО4 + 2КОН = Мn(ОН)2↓+ К2SО4.
Задача 3. Электролиз 400 г 8,5%-ного раствора нитрата серебра продолжали до тех пор, пока масса раствора не уменьшилась на 25 г. Вычислите массовые доли соединений в растворе, полученном после окончания электролиза, и массы веществ, выделившихся на инертных электродах.
Решение. При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg+, а на аноде — окисление молекул воды:
Катод: Аg+ + е = Аg.
Анод: 2Н2О — 4е = 4Н+ + О2.
4AgNО3 + 2Н2О = 4Ag↓ + 4НNО3 + О2↑.
v(АgNО3) = 400.0,085 / 170 = 0,2 моль. При полном электролитическом разложении данного количества соли выделяется 0,2 моль Аg массой 0,2.108 = 21,6 г и 0,05 моль О2 массой 0,05.32 = 1,6 г. Общее уменьшение массы раствора за счет серебра и кислорода составит 21,6+1,6 = 23,2 г.
При электролизе образовавшегося раствора азотной кислоты разлагается вода:
Потеря массы раствора за счет электролиза воды составляет 25 — 23,2 = 1,8 г. Количество разложившейся воды равно: v(Н20) = 1,8/18 = 0,1. На электродах выделилось 0,1 моль Н2 массой 0,1.2 = 0,2 г и 0,1/2 = 0,05 моль О2 массой 0,05.32 = 1,6 г. Общая масса кислорода, выделившегося на аноде в двух процессах, равна 1,6+1,6 = 3,2 г.
В оставшемся растворе содержится азотная кислота: v(НNO3) = v(AgNО3) = 0,2 моль, m(НNО3) = 0,2.63 = 12,6 г. Масса раствора после окончания электролиза равна 400-25 = 375 г. Массовая доля азотной кислоты: ω(НNО3) = 12,6/375 = 0,0336, или 3,36%.
Ответ. ω(НNО3) = 3,36%, на катоде выделилось 21,6 г Аg и 0,2 г Н2, на аноде — 3,2 г О2.
Задача 4. Составить уравнение реакции восстановления Fe3O4 водородом.
Решение. Запишем схему процесса с указанием изменения степеней окисления элементов:
Составляем электронные уравнения:
Найденные коэффициенты проставляем в схему процесса, заменяя стрелку на знак равенства:
Fе3О4 + 4Н2 = ЗFе + 4Н2О
Задача 5. Составьте схемы электролиза водных растворов: а) сульфата меди б) хлорида магния;
в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
а) В растворе сульфат меди диссоциирует на ионы:
СuSО4 
Ионы меди могут восстанавливаться, на катоде в водном растворе. Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды. Схема электролиза:
б) Диссоциация хлорида магния в водном растворе:
MgCl2+ 
Ионы магния не могут восстанавливаться в водном растворе (идет восстановление воды), хлорид-ионы — окисляются. Схема электролиза:
в) Диссоциация сульфата калия в водном растворе:
К2SО4 
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно, на катоде будет протекать восстановление, а на аноде — окисление воды. Схема электролиза:
или, учитывая, что 4Н+ + 4ОН — = 4Н2О (осуществляется при перемешивании),
2H2O 
Запомни: Окислители KMnO4, Na2Cr2O7 в зависимости от среды восстанавливаются до:
ü В сильнокислой среде Mn2+ и Cr3+
ü В нейтральной среде MnO2 и Cr(ОН)3
ü В сильно щелочной среде MnO42- и [Cr(ОН)4 ]-
При составлении уравнений, в случае необходимости, можно добавлять воду, соответствующую кислоту или щелочь, как в левую так и в правую части уравнения.
Концентрированная азотная кислота при реакции с малоактивным металлом выделяет NO2 и воду, а разбавленная NO и воду.
1.В реакции оксида железа (ІІІ) с водородом восстановителем является:
1)H02 2)Al0 3)Fe0 4)O-2
2.Веществом, не проявляющим восстановительные свойства, является:
1)NaI 2)Na2S 3)Na2SO3 4)Na2SO4
3.Оксид углерода (ІІ) проявляет восстановительные свойства при нагревании с:
1)N2 2)CO2 3)Fe 4)Fe2O3
4.Восстановительные свойства железа проявляется в реакции:
1) FeO+H2SO4= FeSO4+H2O 3)2FeCl2+Cl2=2FeCl3
2) Fe(OH)2+2HCl= FeCl2+2H2O 4)FeCl2+2NaOH= Fe(OH)2+2NaCl
5.Оксид железа (ІІІ) проявляет окислительные свойства при взаимодействии с:
1) гидроксидом натрия 3) серной кислотой
2) оксидом углерода(ІІ) 4) хлороводородом
6.Коэффициент перед формулой окислителя в уравнении реакции, схема которой

7.В реакции, схема которой C+HNO3=NO2+CO2+H2O, коэффициент перед формулой восстановителя равен: 1)1 2)2 3)3 4)4
8.Схема превращения S-2→S+4 соответствует уравнение реакции:
1)2H2S+O2 (недостаток) =2S+2H2O 3) 2H2SO3+H2O2=H2SO4+H2O
2) 2H2S+3O2 (избыток) =2SO2+2H2O 4) 4H2O2+PbSO4=PbSO4+4H2O
9.Установите соответствие между уравнением реакции и веществом-окислителем, участвующим в данной реакции.
УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ
А)2NO + 2H2=N2+2H2O 1) H2
Б)2NH3+Na=2 NaNH2+ H2 2) NO
B) H2+2 Na= NaH 3) N2
Г) NH3+6 NO=5 N2+6 H2O 4) NH3
10. При электролизе водного раствора какой соли на катоде и аноде будут выделятся газообразные вещества?
1/ AgNO3 2/KNO3 3/CuCl2 4/SnCl2
11. Водород образуется при электролизе раствора:
1/ CaCl2 2/CuSO4 3/Hg(NO3)2 4/AgNO3
12. При электролизе водного раствора нитрата калия на аноде выделяется:
1/ O2 2/NO2 3/N2 4/H2
13. Азотная кислота накапливается в электролизе при пропускании электрического тока через водный раствор:
1/ нитрата калия 2/ нитрата алюминия 3/ нитрата магния 4/ нитрата меди
14.Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А)Al2(SO4)3 1/ гидроксид металла, кислота
Б)CsOH 2/ металл, галоген
В)Hg(NO3)2 3/металл, кислород
Г)AuBr3 4/водород, галоген
6/металл, кислота, кислород
15. Установите соответствие между металлом и способом его электролитического получения:
НАЗВАНИЕ МЕТАЛЛА ЭЛЕКТРОЛИЗ
А) натрий 1)водного раствора солей
Б) алюминий 2)водного раствора гидроксида
В) серебро 3)расплава поваренной соли
Г) медь 4)расплавленного оксида
5)раствора оксида в расплавленном криолите
16. Напишите уравнение реакции, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора сульфата меди(ІІ) на инертных электродах.
17. Напишите уравнение реакции, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора сульфата натрия на инертных электродах.
18. Используя метод электронного баланса, составьте уравнение реакции, определите окислитель, восстановитель.

19. Используя метод электронного баланса, составьте уравнение реакции, определите окислитель, восстановитель.

20. Используя метод электронного баланса, составьте уравнение реакции, определите окислитель, восстановитель.

21. Используя метод электронного баланса, составьте уравнение реакции, определите окислитель, восстановитель.

22. Используя метод электронного баланса, составьте уравнение реакции, определите окислитель, восстановитель.

Видео:FeSO4+KMnO4+H2SO4=Fe2(SO4)3+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать
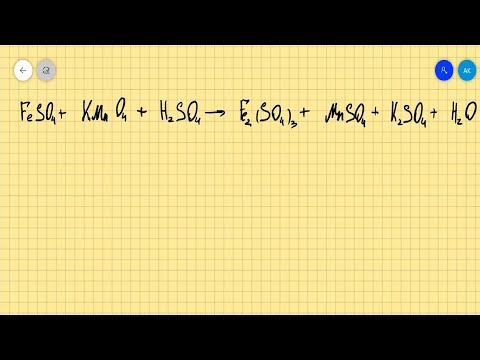
В молекулярном уравнении реакции Ва + Н2SО4 = ВаSО4 + Н2О + Н2S Сумма всех коэффициентов?
Химия | 5 — 9 классы
В молекулярном уравнении реакции Ва + Н2SО4 = ВаSО4 + Н2О + Н2S Сумма всех коэффициентов.
4Ва + 5Н2SО4 — — — — — — > ; 4ВаSО4 + 4Н2О + Н2S Сумма коэффициентов равна : 4 + 5 + 4 + 4 + 1 = 18.
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Сумма коэффициентов в сокращенном ионно — молекулярном уравнении реакции между сероводородной кислотой и гидроксидом натрия равна?
Сумма коэффициентов в сокращенном ионно — молекулярном уравнении реакции между сероводородной кислотой и гидроксидом натрия равна.
Составьте молекулярное и ионное уравнения реакций взаимодействия гидроксида хрома (III) с концентрированным раствором щелочи.
Укажите сумму коэффициентов в последнем уравнении.
Видео:NaNO2+KMnO4+H2SO4=NaNO3+MnSO4+K2SO4+H2OСкачать

Сумма коэффициентов в молекулярном уравнении реакции : С2Н12 + О2 = СО2 + Н2О?
Сумма коэффициентов в молекулярном уравнении реакции : С2Н12 + О2 = СО2 + Н2О.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Укажите суммы всех коэффициентов в молекулярном, полном ионно — молекулярном и кратком ионно — молекулярном уравнениях реакции гидроксида калия с сероводородной кислотой, приводящей к образованию суль?
Укажите суммы всех коэффициентов в молекулярном, полном ионно — молекулярном и кратком ионно — молекулярном уравнениях реакции гидроксида калия с сероводородной кислотой, приводящей к образованию сульфита.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Закончите уравнение реакции в молекулярной форме и подсчитайте сумму стехиометрических коэффициентов :H2C2O4 + MnO4 + H = ?
Закончите уравнение реакции в молекулярной форме и подсчитайте сумму стехиометрических коэффициентов :
H2C2O4 + MnO4 + H = .
Видео:KMnO4+Na2SO3+H2SO4=K2SO4+MnSO4+Na2SO4+H2O balance the chemical equation by algebraic method.Скачать

Сумма коэффициентов в молекулярном уравнении реакции C5H12 + O2 = CO2 + H2O?
Сумма коэффициентов в молекулярном уравнении реакции C5H12 + O2 = CO2 + H2O.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Помогите пожалуйста срочно прошу вас Написать молекулярное и ионное уравнения реакций?
Помогите пожалуйста срочно прошу вас Написать молекулярное и ионное уравнения реакций.
Подписать сумму коэффициентов MgCl + NaOH — > ;
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Чему равна сумма коэффициентов в кратком ионно — молекулярном уравнении реакции между гидрокарбонатом натрия и раствором соляной кислоты?
Чему равна сумма коэффициентов в кратком ионно — молекулярном уравнении реакции между гидрокарбонатом натрия и раствором соляной кислоты.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Сумма всех коэффициентов в молекулярном уравнении реакции, схема которой ВаО + Нз Р04 = Ва3 (Р04)2 + ?
Сумма всех коэффициентов в молекулярном уравнении реакции, схема которой ВаО + Нз Р04 = Ва3 (Р04)2 + .
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Закончить молекулярное уравнение и написать полные и краткие ионные уравнения реакций взаимодействия следующих веществ : Fe(OH)3 + HBr → ?
Закончить молекулярное уравнение и написать полные и краткие ионные уравнения реакций взаимодействия следующих веществ : Fe(OH)3 + HBr → .
1. Укажите сумму всех коэффициентов в полном ионно — молекулярном уравнении
Укажите коэффициент перед формулой слабого электролита в молекулярном уравнении
Укажите сумму всех коэффициентов в кратком ионно — молекулярном уравнении.
На этой странице сайта вы найдете ответы на вопрос В молекулярном уравнении реакции Ва + Н2SО4 = ВаSО4 + Н2О + Н2S Сумма всех коэффициентов?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
3) HCl + NH3 = NH4CL + H2(или H2O) Al + 3Cl = AlCl3 4) N — 2период 5 группа заряд ядра 7 . 7 электронов и протонов, 14 — 7 = 7 нейтронов 5 электронов во внешнем энергетическом уровне. 5)наверное фосфор.
🎬 Видео
Найдите сумму коэффициентов в правой части уравнения. H2S + H2SO4 + K2Cr2O7 = Cr2(SO4)3 + SСкачать

KMnO4+H2S+H2SO4=S+MnSO4+K2SO4+H2O balance the chemical equation by algebraic method or abcd method.Скачать

Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Химическая реакция KMnO4 с H2SO4 и H2O2Скачать

KMnO4 + Na2SO3 → MnO2 + Na2SO4 + KOHСкачать

KMnO4+H2C2O4 + H2SO4 → K2SO4 + MnSO4 + CO2 + H2OСкачать

Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

2 KMnO4 + H2O2 → 2 MnO2 + 2 O2 + 2 KOHСкачать
















