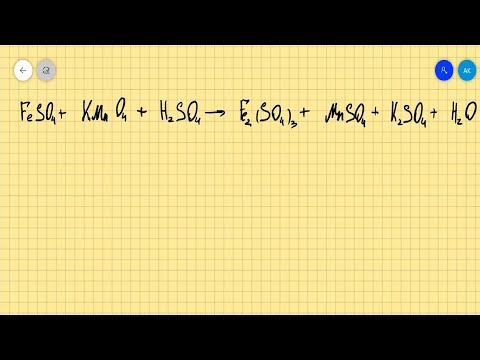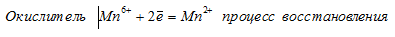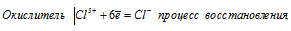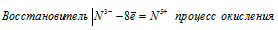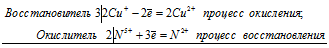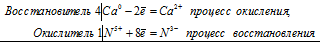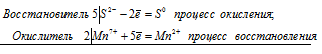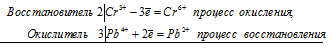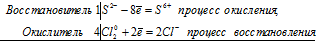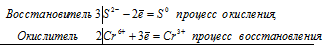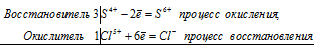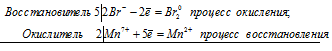Химия | 5 — 9 классы
Сумма коэффициентов в уравнении cr(oh)3 + h2so4 = cr(so4)3 + h2o
А) 12 б) 11 в) 13 г) 14.
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
- СРОЧНО?
- Сумма всех коэффициентов в уравнении cl2 + H2o — > ; HCL + o2?
- Сумма всех коэффициентов в уравнении электролитической диссоциации Fe2(SO4)3?
- Расставьте коэффициенты в уравнении реакции : P + HNO3 + H2O → H3PO4 + NO запишите сумму коэффициентов?
- Сумма всех коэффициентов в уравнении : Na + S = Na2?
- Сумма коэффициентов в уравнении реакции горения магния?
- Допишите уравнение химической реакции N2 + H2 =Сумма коэффициентов в уравнении этой реакции?
- Сумма всех коэффициентов в уравнении реакции к + о2 к2о равна :Помогите?
- Напишите уравнения всех возможных реакций между следующими веществами : MgO, NaOH, HSO₄, СО₂ (IV)?
- Расставить коэффициенты в уравнениях?
- Сумма коэффициентов в уравнении С + О2 = СО2?
- Химия. 9 класс
- Методы составления уравнений окислительно-восстановительных реакций
- Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
- 📽️ Видео
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

СРОЧНО?
NaOH + H2SO4 сумма коэффициентов ионного уравнения.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Сумма всех коэффициентов в уравнении cl2 + H2o — > ; HCL + o2?
Сумма всех коэффициентов в уравнении cl2 + H2o — > ; HCL + o2.
Видео:Найдите сумму коэффициентов в правой части уравнения. H2S + H2SO4 + K2Cr2O7 = Cr2(SO4)3 + SСкачать

Сумма всех коэффициентов в уравнении электролитической диссоциации Fe2(SO4)3?
Сумма всех коэффициентов в уравнении электролитической диссоциации Fe2(SO4)3.
Видео:Na2S+Na2Cr2O7+H2SO4=S+Cr2(SO4)3+Na2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать

Расставьте коэффициенты в уравнении реакции : P + HNO3 + H2O → H3PO4 + NO запишите сумму коэффициентов?
Расставьте коэффициенты в уравнении реакции : P + HNO3 + H2O → H3PO4 + NO запишите сумму коэффициентов.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Сумма всех коэффициентов в уравнении : Na + S = Na2?
Сумма всех коэффициентов в уравнении : Na + S = Na2.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Сумма коэффициентов в уравнении реакции горения магния?
Сумма коэффициентов в уравнении реакции горения магния.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Допишите уравнение химической реакции N2 + H2 =Сумма коэффициентов в уравнении этой реакции?
Допишите уравнение химической реакции N2 + H2 =
Сумма коэффициентов в уравнении этой реакции.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Сумма всех коэффициентов в уравнении реакции к + о2 к2о равна :Помогите?
Сумма всех коэффициентов в уравнении реакции к + о2 к2о равна :
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Напишите уравнения всех возможных реакций между следующими веществами : MgO, NaOH, HSO₄, СО₂ (IV)?
Напишите уравнения всех возможных реакций между следующими веществами : MgO, NaOH, HSO₄, СО₂ (IV).
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Расставить коэффициенты в уравнениях?
Расставить коэффициенты в уравнениях.
Сумма коэффициентов равна относительной молекулярной массе гашеной извести.
Видео:В окислительно-восстановительной реакции найдите сумму коэффициентов в правой части уравнения.Скачать

Сумма коэффициентов в уравнении С + О2 = СО2?
Сумма коэффициентов в уравнении С + О2 = СО2.
Вы открыли страницу вопроса Сумма коэффициентов в уравнении cr(oh)3 + h2so4 = cr(so4)3 + h2oА) 12 б) 11 в) 13 г) 14?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
1) 2 метилпентен 1 2) 3 метилпентен 2 3) 4 метилпентен 2 4) 3, 4 диметилгексен 1 5) 4, 5 диметилгексен 2.
1)3, потому что только это соединение диссоциируется(расворима) в воде с образованием OH 2)3, потому что только эта пара диссоциируется(растворима) в воде с образованием катиона Ba 3)4, потому что только эта пара диссоциируется(растворима) в воде с о..
Это 16 — S и 25 — марганец.
Може молекулярна маса оксиду = 230? Бо такого елементу нема якщо 5 група то формула оксиду R2O5 Ar(R) = (230 — (16 * 5)) / 2 = 75 елемент арсен.
Радуга в небе — — физическое явление (преломление света) мяч падает на землю — физич. — сила тяжести Вода кипит в чайнике — физ явление — туман на озере физ явление — испарение воды и конденсация егов воздухе подъем ртутного столбика в градуснике — ..
Считай по кислороду до реакции и после пред 3hno3 и перед 2no3.
CH3 — C(CH3)2 — C = C(C2H5) — CH2 — CH3 CH3 | CH3 — C — C = C — CH2 — CH3 | | CH3 C2H5.
Газ — иодоводород, HI Прекрасно растворяется в воде, образует сильную кислоту, диссоциирующую на два иона : HI = H( + ) + I( — ).
Валентные электроны находятся на последнем электронном слое, орбитали не могут быть валентными.
Здесь четыре вида веществ : кислота, соль, оксид, гидроксид.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химия. 9 класс
С какими из перечисленных веществ может взаимодействовать оксид серы (VI)?
Расположите пропущенные вещества в приведенных схемах химических реакций.
Установите соответствие между левой и правой частями уравнения химической реакции.
Какой из приведенных металлов может взаимодействовать с концентрированной серной
кислотой только при нагревании?
Распределите предложенные схемы химических реакций на две группы: «Типичные кислотные
свойства» и «Окислительные свойства серной кислоты»
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Методы составления уравнений окислительно-восстановительных реакций
Видео:Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
📽️ Видео
ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

СУММА КОЭФФИЦИЕНТОВ: Как решать Квадратные Уравнения по МАТЕМАТИКЕ 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

FeSO4+KMnO4+H2SO4=Fe2(SO4)3+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать