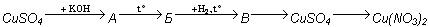Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Химия 9 класс ________________________________
1. Наибольшую молекулярную массу имеет: А) BaCl2; Б) ВаS04; В) Ва3(Р04)2; Г) Ва3Р2.
2. Трехэлементное вещество — это … А) серная кислота; Б) негашеная известь (оксид кальция); В) хлорид железа (III); Г) медный купорос.
З. Сумма коэффициентов в молекулярном уравнении реакции (СuОН)2С03 + НС1 = СuС12 + С02 + …
А) 10; Б) 11; В) 12; Г) 9
4. Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V)
А) 0,5; Б) 0,3; В) 0,03; Г) 0,15
5. Число протонов и нейтронов в ядре изотопа 40 К
А) р = 20, n=19; Б) р = 40, n = 19; В) р= 19, n = 21; Г) р = 21, n=19
6. Реакция, в результате которой выпадает осадок
А) КОН + НС l ; Б) К2С03 + Н2S04; В) Cu(OH)2 +HNO3; Г) Nа2S + Рb(N03)2
7. В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
А) 60; Б) 37,5; В) 75; Г) 62,5
8. Массовая доля кислорода наибольшая в соединении:
А) сульфат калия; Б) сульфит калия; В) фосфат калия; Г) карбонат калия
9. В молекулярном уравнении реакции Ba(OH)2 + Ba(H2PO4)2 —> средняя соль + …
сумма коэффициентов равна:
А) 4; Б) 6; В) 8; Г) 10
10. Масса (в граммах) сернистого ангидрида, занимающего объем при нормальных условиях 7 л, равна:
А) 20; Б) 25; В) 10; Г) 13,75
Химия 9 класс ___________________________________
1. Наибольшую молекулярную массу имеет: А) BaCl2; Б) ВаS04; В) Ва3(Р04)2; Г) Ва3Р2.
2. Трехэлементное вещество — это … А) серная кислота; Б) негашеная известь (оксид кальция); В) хлорид железа (III); Г) медный купорос.
З. Сумма коэффициентов в молекулярном уравнении реакции (СuОН)2С03 + НС1 = СuС12 + С02 + …
А) 10; Б) 11; В) 12; Г) 9
4. Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V)
А) 0,5; Б) 0,3; В) 0,03; Г) 0,15
5. Число протонов и нейтронов в ядре изотопа 40 К
А) р = 20, n=19; Б) р = 40, n = 19; В) р= 19, n = 21; Г) р = 21, n=19
6. Реакция, в результате которой выпадает осадок
А) КОН + НС l ; Б) К2С03 + Н2S04; В) Cu(OH)2 +HNO3; Г) Nа2S + Рb(N03)2
7. В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
А) 60; Б) 37,5; В) 75; Г) 62,5
8. Массовая доля кислорода наибольшая в соединении:
А) сульфат калия; Б) сульфит калия; В) фосфат калия; Г) карбонат калия
9. В молекулярном уравнении реакции Ba(OH)2 + Ba(H2PO4)2 —> средняя соль + …
сумма коэффициентов равна:
А) 4; Б) 6; В) 8; Г) 10
10. Масса (в граммах) сернистого ангидрида, занимающего объем при нормальных условиях 7 л, равна:
А) 20; Б) 25; В) 10; Г) 13,75
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Всероссийская олимпиада по химии (школьный этап)
Задания и ответы для школьного этапа всероссийской олимпиады по химии 9 класс.
Просмотр содержимого документа
«Всероссийская олимпиада по химии (школьный этап)»
Школьный этап всероссийской олимпиады по химии 2016 год.
К каждому заданию даны несколько ответов, из которых только один верный. Выберите верный ответ. Запишите номер задания и поставьте номер выбранного ответа.
1. Наибольшую молекулярную массу имеет
2. Трехэлементное вещество — это .
1) серная кислота; 2) негашеная известь (оксид кальция);
3) хлорид железа (III); 4) медный купорос. (1 балл)
З. Сумма коэффициентов в молекулярном уравнении реакции
4. Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V) (2 балла)
1)0,5; 2)0,3; 3)0,03; 4)0,15.
5. Масса (в граммах) навески нитрата алюминия, в которой содержится 3,612∙10 23 атомов азота
1)127,8; 2)42,6; 3)213; 4)14,2. (2 балла)
6. Число протонов и нейтронов в ядре изотопа 40 К
1) р = 20, n=19; 2)р = 40, n = 19; 3)р= 19,n = 21: 4)р= 21,n=19. (2 балл)
7. Реакция, в результате которой выпадает осадок
8. При взаимодействии смеси цинка (5,2г) и карбоната цинка (5,0 г) с соляной кислотой выделяются газы объемом (н.у.) (2 балла)
1)0,896 л; 2) 1,792 л; 3)2,688 л: 4) 22,4 л.
9. В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
1) 60; 2) 37,5; 3) 75; 4) 62,5 (2 балла)
10. Молярная масса газа массой 0,84 г, занимающего объем 672 мл (н.у.), равна
1)44; 2)28; 3)32; 4)16. (2 балла)
Итого 18 баллов
ЧАСТЬ 2 (цепочки превращений)
Шел солдат по полю, решил привал сделать, письмо написать родным, да нечем. Тут он нашел черный камешек, попробовал – рисует. Написал этим камешком письмо, да поспать решил. Бросил камешек в огонь – тот вспыхнул, только дым пошел. Дождь дым остановил, к земле прибил; водица текла тяжелая, известковая. Стала сохнуть вода, кое-где осталась, а где высохла – там уже белые камешки лежали. Проснулся солдат, удивился, как дождь из черного камешка белый сделал. Взял он белый камешек, провел им по белому валуну, глядь – а он рисует. Удивился солдат и пошел дальше.
Составьте цепочку превращений и решите ее. (8 баллов)
Напишите уравнения реакций, соответствующие следующим превращениям (А, Б, В — соединения меди):
Конструкторы первых космических кораблей и подводных лодок столкнулись с проблемой: как поддерживать на судне или космической станции постоянный состав воздуха, т.е. как избавиться от избытка углекислого газа и возобновить запас кислорода? Решение было найдено изящное — надо превратить СО2в О2! Для этого было предложено использовать надпероксид калия (КО2), который образуется при сгорании калия в кислороде. При взаимодействии надпероксида калия с углекислым газом выделяется кислород в свободном виде (атомы кислорода являются и окислителем, и восстановителем одновременно). Составьте уравнения реакций, о которых идет речь в тексте. Зная, что в сутки человек выделят в среднем 0,51 м 3 углекислого газа, рассчитайте, какое количество надпероксида калия должно быть на борту космической станции, чтобы обеспечить жизнедеятельность экипажа, состоящего из трех человек в течение месяца (30 дней). (24 балла)
Юный химик получил от учителя четыре склянки без этикеток, содержащие растворы гидроксида калия, хлорида цинка, хлорида бария и сульфида калия. Концентрация веществ в каждом из выданных растворов составляла 0,1 моль/л. Как, не используя дополнительные реактивы и имея в своем распоряжении только фенолфталеиновую бумагу (бумагу, пропитанную спиртовым раствором фенолфталеина), определить содержимое склянок? Предложите последовательность действий юного химика. Запишите уравнения происходящих реакций. (40 баллов)
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Олимпиада по химии для 9 класса
Навигация (только номера заданий)
0 из 10 заданий окончено
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Информация
Ответьте на 10 вопросов и получите мгновенный результат!
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
Результаты
Правильных ответов: 0 из 10
Вы набрали 0 из 0 баллов ( 0 )
| Средний результат | |
| Ваш результат | Рубрики
Вы ответили правильно на все вопросы олимпиады и заняли 1 место! Вы можете заказать изготовление персонального диплома 1 степени Вы ответили правильно на большую часть вопросов олимпиады и заняли 2 место! Вы можете заказать изготовление персонального диплома 2 степени Вы ответили правильно на большую часть вопросов олимпиады и заняли 3 место! Вы можете заказать изготовление персонального диплома 3 степени Вы ответили правильно на большую часть вопросов олимпиады! Вы можете заказать изготовление персонального диплома участника олимпиады.
Наибольшую молекулярную массу имеет
Трехэлементное вещество — это …
Сумма коэффициентов в молекулярном уравнении реакции (СuОН)2С03 + НС1 = СuС12 + С02 + …
Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V)
Число протонов и нейтронов в ядре изотопа 40 К
Реакция, в результате которой выпадает осадок
В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
Массовая доля кислорода наибольшая в соединении:
В молекулярном уравнении реакции Ba(OH)2 + Ba(H2PO4)2 —> средняя соль + … сумма коэффициентов равна:
Масса (в граммах) сернистого ангидрида, занимающего объем при нормальных условиях 7 л, равна:
Видео:СУММА КОЭФФИЦИЕНТОВ: Как решать Квадратные Уравнения по МАТЕМАТИКЕ 8 классСкачать  Об олимпиадеЭто олимпиада по химии для 9 класса. В 9 классе школьники знают ОГЭ. Некоторые из них могут выбрать для сдачи химию. А наша олимпиада может помочь им подготовиться к экзамену. Наша олимпиада состоит из 10 вопросов. Каждый вопрос имеет 4 варианта ответа. Но лишь один из них является верным. После ответа на все вопросы ваш ребенок получит грамоту. Он вложит ее в портфолио. Также у нас есть и другие олимпиады для 9 класса. Посмотреть их можно по ссылке ниже. А еще вы можете прочитать положение о проведении олимпиады. Это тоже можно сделать по ссылке ниже. Желаем удачи! 🎦 ВидеоРасстановка коэффициентов в химических реакциях: как просто это сделатьСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  25. Схема реакции и химическое уравнениеСкачать  Химия | Молекулярные и ионные уравненияСкачать  Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать  Найдите сумму коэффициентов в правой части уравнения. H2S + H2SO4 + K2Cr2O7 = Cr2(SO4)3 + SСкачать  МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать  Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать  как составить к сокращенному ионному уравнению молекулярноеСкачать  Реакции ионного обмена. 9 класс.Скачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать  Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать  Химия | Относительная атомная и молекулярная массаСкачать  Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать  8 класс. Химия. Химические формулы. Относительная молекулярная массаСкачать  |