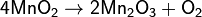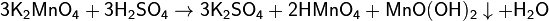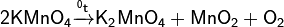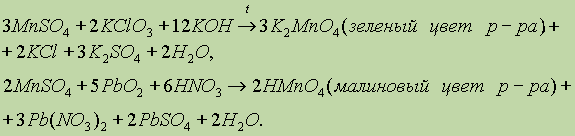Mn(OH)2 + 2HCl = MnCl2 + 2H2O — молекулярное уравнение
Mn(OH)2 + 2H(+) + 2Cl(-) = Mn(+2) + 2Cl(-) + 2H2O полное ионно- молекулярное уравнение ,
Mn(OH)2 + 2H(+) = Mn(+2) + 2H2O — сокращённое ионно-молекулярное уравнение .
- Оксиды и гидроксиды марганца
- Сумма коэффициентов в уравнении реакции соляной кислоты с гидроксидом железа 3 равна : 4 6 8 10?
- Напишите уравнения реакций между гидроксидом железа (III) и след?
- Сумма коэффициентов в сокращенном ионном уравнении реакции между сульфатом железа (3) и гидроксидом натрия равна ?
- Составьте уравнения реакций 1?
- Сумма коэффициентов в уравнении реакции между алюминием и соляной кислотой равна?
- Сумма коэффициентов в уравнении реакции между гидроксидом железа 2 и азойской кислотой равна?
- Сумма коэффициентов в кратком ионном уравнении реакции между карбонатом кальция и соляной кислотой равна?
- Сумма коэффициентов в полном ионном уравнении реакции между гидроксидом алюминия и раствором соляной кислоты равна?
- Составьте молекулярные и ионные уравнения реакций между а) серной кислотой и гидроксидом натрия б) соляной кислотой и гидроксидом железа 3?
- Сумма всех коэффициентов в уравнении реакции взаимодействия нитрата серебра с соляной кислотой равна?
- 1. Составить молекулярные и ионные уравнения реакций между веществами : сульфид натрия и соляная кислота карбонат калия и азотная кислота гидроксид свинца и соляная кислота гидроксид железа (III) и со?
- Сумма коэффициентов в кратком ионном уравнении реакции гидроксида марганца 2 и соляной кислоты равна
- 🌟 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Оксиды и гидроксиды марганца
Получение марганца
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
Химические свойства
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Оксиды и гидроксида марганца
| Оксиды | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | Сильно кислотные |
| Гидроксиды | Mn(OH)2 | Mn(OH)3 | Mn(OH)4 H2MnO3 | H2MnO4 | HMnO4 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | сильно кислотные |
| Названия | гидроксид марганца (II); солиMn(II) | гидроксид марганца (III); солиMn(III) | гидроксид марганца (IV); манганаты(IV) | Марганцевая (VI) кислота; манганаты(VI) | марганцевая (VII)кислота;перманганаты |
Оксиды и гидроксиды марганца
Соединения марганца (II).Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца.
Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат.
В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха:
Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О
MnO — типичный основной оксид, с водой в реакцию не вступает. Ему соответствует гидроксид марганца (II), Mn(ОН)2, представляющий собой слабое основание. В виде осадка телесного цвета выпадает при взаимодействии щелочей с солями марганца (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Соли марганца (II), как правило, хорошо растворимы в воде, кроме Mn3(PO4)2, MnS, MnCO3.
Соединения марганца (III).Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) –Mn2O3 ּН2О или MnО(OH) встречается в природе в виде минерала манганита(бурая марганцевая руда).
• В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными примесями.
• Окисление оксида марганца(II):
• Восстановление оксида марганца(IV):
Соединения марганца (IV).Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца.MnO2 и соответствующий ему гидроксид практически нерастворимы в воде.
Получение оксида марганца 4:
· В лабораторных условиях получают термическим разложением перманганата калия.
· но реакция, в действительности, следует по уравнению:
· Также можно получить реакцией перманганата калия с пероксидом водорода.
· При температуре выше 100 °C перманганат калия восстанавливается водородом:
Химические свойства
1)При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2) Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (по этой реакции в лабораториях получают хлор)
3) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (реакция идет при сплавлении)
Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
Соединения марганца (VI).Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме:
Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием:
Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде доMn(II), а в нейтральной и щелочной средах – доMnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены доMn(VII):
При нагревании выше 500 о С манганат (VI) распадается на продукты:
манганат (IV) и кислород:
Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия:
Оксид марганца (VII) устойчив до 10 о С и разлагается со взрывом по схеме:
При взаимодействии Mn2O7с водой образуется марганцовая кислотаHMnO4, которая имеет фиолетово-красную окраску:
Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм 3 равна 93 %.
Марганцовая кислота – сильный окислитель.Еще энергичнее взаимодействуетMn2O7, горючие вещества при соприкосновении с ним воспламеняются. Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
3) Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :

4) Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями:
8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Применение цветов:
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Сумма коэффициентов в уравнении реакции соляной кислоты с гидроксидом железа 3 равна : 4 6 8 10?
Химия | 5 — 9 классы
Сумма коэффициентов в уравнении реакции соляной кислоты с гидроксидом железа 3 равна : 4 6 8 10.
3HCl + Fe(OH)3 = FeCl3 + 3H2O (3 + 1 + 1 + 3 = 8).
Видео:Получение гидроксида марганца II и изучение его свойствСкачать

Напишите уравнения реакций между гидроксидом железа (III) и след?
Напишите уравнения реакций между гидроксидом железа (III) и след.
Веществами : а) азотной кислотой ; б) серной кислотой ; в) соляной кислотой ; в) соляной кислотой.
К какому типу относятся все эти реакции?
Видео:Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Сумма коэффициентов в сокращенном ионном уравнении реакции между сульфатом железа (3) и гидроксидом натрия равна ?
Сумма коэффициентов в сокращенном ионном уравнении реакции между сульфатом железа (3) и гидроксидом натрия равна :
Видео:Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Составьте уравнения реакций 1?
Составьте уравнения реакций 1.
Гидроксид кальция с соляной кислотой 2.
Гидроксид алюминия с соляной кислотой 3.
Гидроксид железа(3) с серной кислотой.
ПОМОГИТЕ ПОЖАЛУЙСТА СРОЧНО!
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Сумма коэффициентов в уравнении реакции между алюминием и соляной кислотой равна?
Сумма коэффициентов в уравнении реакции между алюминием и соляной кислотой равна.
Видео:Гидроксид марганца (II) и его свойства.Скачать

Сумма коэффициентов в уравнении реакции между гидроксидом железа 2 и азойской кислотой равна?
Сумма коэффициентов в уравнении реакции между гидроксидом железа 2 и азойской кислотой равна?
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Сумма коэффициентов в кратком ионном уравнении реакции между карбонатом кальция и соляной кислотой равна?
Сумма коэффициентов в кратком ионном уравнении реакции между карбонатом кальция и соляной кислотой равна.
Видео:Реакции ионного обмена. 9 класс.Скачать

Сумма коэффициентов в полном ионном уравнении реакции между гидроксидом алюминия и раствором соляной кислоты равна?
Сумма коэффициентов в полном ионном уравнении реакции между гидроксидом алюминия и раствором соляной кислоты равна.
Видео:Получение и исследование свойств гидроксида марганца (II).Скачать

Составьте молекулярные и ионные уравнения реакций между а) серной кислотой и гидроксидом натрия б) соляной кислотой и гидроксидом железа 3?
Составьте молекулярные и ионные уравнения реакций между а) серной кислотой и гидроксидом натрия б) соляной кислотой и гидроксидом железа 3.
Видео:Полный разбор варианта ОГЭ | Химия 2023 | УмскулСкачать

Сумма всех коэффициентов в уравнении реакции взаимодействия нитрата серебра с соляной кислотой равна?
Сумма всех коэффициентов в уравнении реакции взаимодействия нитрата серебра с соляной кислотой равна?
Пишите уравнении реакции.
Видео:Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

1. Составить молекулярные и ионные уравнения реакций между веществами : сульфид натрия и соляная кислота карбонат калия и азотная кислота гидроксид свинца и соляная кислота гидроксид железа (III) и со?
1. Составить молекулярные и ионные уравнения реакций между веществами : сульфид натрия и соляная кислота карбонат калия и азотная кислота гидроксид свинца и соляная кислота гидроксид железа (III) и соляная кислота.
Вы открыли страницу вопроса Сумма коэффициентов в уравнении реакции соляной кислоты с гидроксидом железа 3 равна : 4 6 8 10?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
У меня так получилось 2AlCl3 + 3Ba(OH)2 = 3BaCl2 + 2Al(OH)3 2Al( + 3) + 6Cl( — ) + 3Ba( + 2) + 6OH( — ) = 3Ba( + 2) + 6Cl( — ) + 2Al(OH)3 Al( + 3) + 3OH( — ) = Al(OH)3.
Вот, должно быть так, но в первом я не понимаю. Если бы там был сульфит, то всё бы пошло.
1) Ar(HCl) = 1 + 35. 5 = 36, 5 г / моль Ar(Na2CO3) = 23 * 2 + 12 + 16 * 3 = 106 г / моль Ar(KMnO4) = 39 + 55 + 16 * 4 = 148 г / моль Ar (NaOH) = 23 + 16 + 1 = 40 г / моль 2) w(Fe) = 56 / 72 * 100% = 77, 7% w(Fe) = 56 / 160 * 100% = 46, 6% w(Fe) = 56..
NaOH + Na₂HPO₄ = Na₃PO₄ + H₂O NaOH + HCl = NaCl + H₂O Na₂HPO₄ + HCl = NaCl + NaH₂PO₄.
X — массовая доля изотопа 63 100 — х — массовая доля изотопа 65 63х + 65(100 — х) = 63, 45 63х + 6500 — 65х — 63, 45 = 0 6436, 46 — 2х = 0 2х = 6436, 46 х = 3218, 23 ; массовая доля изотопа 63 — 32, 1823% 100 — х = 6781, 77.
Видео:Получение и исследование свойств гидроксида марганца (II).Скачать

Сумма коэффициентов в кратком ионном уравнении реакции гидроксида марганца 2 и соляной кислоты равна
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu 2 + + SO4 2- + 2Na + + 2OH — = 2Na + + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
2Al 3+ + 3SO4 2- + 3Ba 2+ + 6Cl — = 3BaSO4↓ + 2Al 3+ + 6Cl —
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + CO2↑ + H2O + 2Cl —
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K + + OH — + NH4 + + Cl — = K + + Cl — + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H + и CO3 2- .
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
6H + +2 PO4 3- + 6 K + + 3CO3 2- -> 6 K + + 2 PO4 3- + 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H + -> 6Na + + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H + -> 2Na + + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
🌟 Видео
Щёлочи: химические свойства и способы получения #основания #гидроксиды #щелочи #химшкола #видеоурокСкачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

ВСЕ неорганические реакции | ЕГЭ по Химии | Катя СтрогановаСкачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Реакция цинка с соляной кислотой. Химический опытСкачать