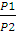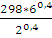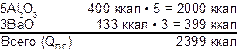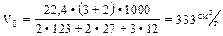Первый закон термодинамики есть закон сохранения энергии в применении его к термодинамическим процессам. Можно дать несколько, по существу равноценных, формулировок этого закона:
а) общая энергия изолированной системы остается постоянной независимо от каких бы то ни было изменений, происходящих в этой системе;
б) изменение внутренней энергии системы (∆U) равно разности между количеством сообщенной системе теплоты q и количеством работы А, совершенной системой.
Математическое выражение первого закона термодинамики будет иметь вид:
q — считается положительной, если теплота поглощается системой, и отрицательной, если теплота выделяется [2].
Из первого закона термодинамики вытекает ряд следствий, имеющих большое значение для физической химии и решения различных технологических задач. Мы ограничимся применением первого закона термодинамики только для идеальных газов и рассмотрим важнейшие процессы: изохорический, изобарический, изотермический и адиабатический.
Изохорический процесс протекает при постоянном объеме, поэтому система никакой работы не совершает. В этом случае вся теплота расходуется на увеличение внутренней энергии системы. Если V — соnst, то A=0, тогда
При изохорическом процессе количество теплоты, получаемое системой, можно вычислить по уравнениям:
гдеn — количество вещества; р1 и р2 — соответственно начальное и конечное давление системы; — молярная теплоемкость при постоянном объеме; T1 — начальная температура; T2 — конечная температура.
Если теплота поглощается системойпри постоянном давлении, то в системе соответственно увеличивается энтальпия. Если р = const, то
∆U = qp — А, но ∆U + А = ∆H. Тогда qp = ∆H (2.4)
Количество теплоты, получаемое системой в этих условиях, может быть вычислено по уравнениям:
qp = 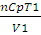
где Ср — молярная теплоемкость при постоянном давлении; V1 и V2 -соответственно начальный и конечный объем системы.
Работа при изобарическом процессе выражается уравнением:
Если совершается изотермический процесс, то внутренняя энергия системы при этом не меняется. Вся сообщаемая теплота расходуется на работу по расширению системы.
Если T = сonst, то ∆U = 0, тогда q = A.
Работа изотермического расширения системы может быть вычислена по уравнениям:
А = nRТ -2,3 lg 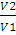
A = nRТ -2,3 lg 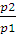
При адиабатическом процессе теплообмен между данной системой и окружающей средой отсутствует, поэтому q = 0. При этом система может совершать работу только за счет убыли внутренней энергии: А = -∆U. Работа в этом случае может быть вычислена по одному из следующих уравнений:
A = 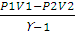
A = 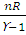
ϒ = 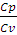
Связь между давлением, объемом и температурой в начале и конце адиабатического процесса выражается уравнениями:
Для одноатомных газов
Cv = 

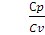
Для двухатомных газов
Cv = 

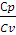
Примеры
1. Путем нагревания при постоянном давлении в 1,013∙10 5 Па газу сообщено 2093,4 Дж теплоты. Определить изменение внутренней энергии этого газа, если он при этом расширился от 0,01 до 0,02 м 3 .
Решение: Согласно первому закону термодинамики ∆U = q — А. Работа, совершенная газом при изобарическом расширении, может быть вычислена по уравнению (2.7):
А = 1,013 . 10 5 Па • (0,02 м 3 — 0,01 м 3 ) = 1013 Дж
Отсюда ∆U = 2093,4 — 1013 = 1080,4 (Дж).
2. Гелий массой 75 г нагревали при температуре 100 °С и давлении 1,013 • 10 5 Па. Вычислить количество затраченной теплоты, если объем газа изменился от 3 до 15 л.
Решение: Так как нагревание газа происходит изотермически и изобарически, то количество затраченной теплоты можно вычислить по уравнению (2.6), только дополнительно необходимо определить количество вещества п и молярную теплоемкость гелия при постоянном давлении:
n (Не) = 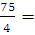
Гелий — одноатомный газ, поэтому согласно формуле (2.16)
Ср = 
qp = 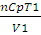
qp = 18,75•20,79•373/3• (15 – 3) = 581600 (Дж) или 582 кДж
3. Определить работу, совершаемую азотом при изотермическом (20 ºС) расширении его от 0,015 до 0,1 м 3 , если начальное давление было 3,039 • 10 5 Па. Каково будет конечное давление?
Решение. Для изотермического процесса работа расширения газа может быть вычислена по уравнению (2.8). Количество вещества азота находим из уравнения состояния идеального газа:
n(N2) = 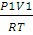
n(N2) = 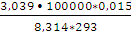
А = пКТ • 2,3lg 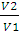
А= 1,875 • 8,314 • 293 • 2,3 lg 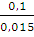
Конечное давление газа при постоянной температуре и известном объеме находим по закону Бойля — Мариотта:
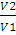
p2 = 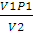
p2 = 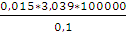
4. Сколько нужно затратить теплоты, чтобы изохорически нагреть кислород массой 25 г от 0 до 50 °С?
Решение. При изохорическом процессе газ никакой работы не совершает, поэтому вся подводимая к газу теплота расходуется на его нагревание. Согласно уравнению (2.2)
qv = nCv(T2 – T1); п (02) = 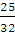
Для двухатомного газа
Cv = 
С = 2,5 • 8,314 = 20,79 (Дж);
qv = 0,781 • 20,79 • (323 — 273) = 812 (Дж)
5. Навеску водорода массой 0,5 г, взятую при 25 °С, адиабатически сжимают от 6 до 2 л. Определить конечную температуру газа и работу, затраченную на его сжатие.
Решение. Связь между объемом и температурой адиабатического процесса показывает уравнение (2.14):
Для двухатомного газа ϒ = 1,40. Из уравнения (2.14) находим Т2:
Т2 = 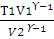
lgT2 = lg 298 + 0,4lg 6 – 0,4lg2 = 2,6651;
Для определения затраченной работы применим уравнение (2.10):
А = пСv (T1 — T2); п (Н2) = 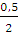
Для двухатомного газа Сv = 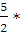
А = 0,25 • 20,79 • (298 — 462,5) = -855 (Дж)
Термохимия
Тепловым эффектом реакции называют теплоту, выделенную или поглощенную в ходе химической реакции, протекающей необратимо при постоянном давлении или постоянном объеме, причем температура исходных веществ (исх) и продуктов реакции (прод) одна и та же. В термодинамике положительной считают ту теплоту, которую подводят к системе (эта теплота поглощается системой), а отрицательной — ту, которую система выделяет. В термохимии приняты обратные обозначения.
Тепловой эффект химической реакции относят обычно к 1 моль образовавшегося вещества (обр). С этой целью нередко в термохимических уравнениях коэффициенты следует брать дробными.
Из первого закона термодинамики (2.1) следует: qv = ∆U; qv = ∆H. Таким образом, тепловой эффект химической реакции при постоянном объеме представляет собой изменение внутренней энергии системы ∆U , а при постоянном давлении — изменение энтальпии ∆H . Разница между∆H и ∆U мала, если реакция идет между жидкими или твердыми веществами. В случае реакций с участием газообразных веществ это различие заметно. Если в реакции участвует п1 моль, а получается п2 моль газообразных веществ, то
В термохимии чаще имеют дело с ∆Н.
Основным законом термохимии является закон Гесса (1840) — частный случай первого закона термодинамики: если процесс идет при постоянном давлении или при постоянном объеме, то тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает. Из закона Гесса вытекают следствия:
1. Тепловой эффект химической реакции равен разности между суммой теплот образования получающихся веществ и суммой теплот образования вступающих в реакцию веществ (с учетом их стехио- метрических коэффициентов):
2. Тепловой эффект химической реакции равен разности между суммой теплот сгорания (сгор) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом их стехиометрических коэффициентов):
Величины стандартных теплот образования и теплот сгорания находят в справочниках. Значение закона Гесса состоит в том, что он позволяет определить тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто, т. е. без побочных процессов [2].
При растворении кристаллогидратов наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Разность между теплотой растворения безводной соли ∆Hбезв и теплотой растворения ее кристаллогидрата ∆Hкр есть теплота гидратации ∆Hгидр:
Примеры
1. Реакция горения ацетилена при стандартных условиях выражается уравнением:
С2Н2 + 2 
Определить теплоту образования ацетилена при постоянном давлении.
Решение. Для решения задачи данный химический процесс следует разбить на отдельные промежуточные стадии:
1) разложение ацетилена на углерод и водород:
2) образование углекислого газа из углерода и кислорода:
2С + 202 = 2С02 — 2 • 393,77 кДж
3) образование жидкой воды из водорода и кислорода:
Н2 + 
Сумма тепловых эффектов всех стадий этого процесса и должна равняться общему тепловому эффекту горения ацетилена:
∆Нх = -226,5 кДж, ∆Нх — теплота разложения ацетилена; следовательно, теплота образования ацетилена при стандартных условиях ∆Н º 298 равна 226,5 кДж.
Теплоту образования ацетилена также можно определить, используя следствие из закона Гесса (2.21), т. е. теплота горения ацетилена будет равна сумме теплот образования 2 моль углекислого газа и 1 моль воды (жидкой) минус теплота образования 1 моль ацетилена:
-2 • 393,77 — 285,96 — ∆Н º 298 = -1300;
∆Н º 298 = 226,5 кДж
2. Процесс алюминотермии выражается химическим уравнением:
Рассчитать, сколько выделится теплоты при сгорании 1 кг термита.
Решение. По теплотам образования участвующих в реакции веществ определим тепловой эффект реакции в целом. Для этого рассмотрим отдельно каждую стадию процесса:
Алгебраическая сумма всех стадий процесса и будет составлять тепловой эффект реакции:
∆H = 3 • 1117,82 — 4 • 1670,5 = -3328,5 кДж
Из уравнения реакции следует, что 3328, 5 кДж теплоты выделяется при взаимодействии алюминия массой 216 г (8 • 27) и магнетита массой 696 г (3 • 232), т. е. при сгорании термита массой 912 г. При сгорании термита массой 1000 г выделится х кДж:
912 : 1000 = -3328,5 : х; х = -365 (кДж)
3. Вычислить тепловой эффект при постоянном давлении и постоянном объеме в стандартных условиях реакции:
Решение. Тепловой эффект реакции может быть рассчитан по теплотам образования участвующих в реакции веществ (2.21). Но в данном случае удобнее его рассчитать по тепловым эффектам сгорания (2.22). В справочнике находим тепловые эффекты полного сгорания всех реагирующих веществ в кислороде. Теплота сгорания этилового спирта равна — 1367,7 кДж. Теплота сгорания СН3СООНж равна — 872,1 кДж. Теплота сгорания Н2Ож равна нулю, так как она высший оксид, продукт полного сгорания водорода в кислороде:
∆Нреакц = — 1367,7 — (-872,1) = — 495,6 (кДж/моль)
∆U º 289 рассчитываем по уравнению (2.20), но предварительно килоджоули переведем в джоули:
∆U º 289 = -495600 – 8,314 • 298 • (0 — 1); ∆U º 289 = — 493 (кДж)
4. На сколько градусов повысится температура при растворении 0,5 моль серной кислоты в воде массой 400 г, если теплота растворения серной кислоты равна — 74,94 кДж, а удельная теплоемкость раствора равна 3,77 Дж/(г • К)?
Решение. 74 940 Дж выделяются при растворении 1 моль кислоты. При растворении же 0,5 моль серной кислоты массой 49 г в воде массой 400 г образуется раствор массой 449 г и выделится 37 470 Дж (74 940 • 0,5). 3,77 Дж нагревают раствор массой 1 г на 1 °С, а 37 470 Дж нагревают на ∆t:
449 • 3,77 • ∆t = 37 470. Отсюда ∆t = 22,14 °С.
5. При растворении сульфата меди массой 8 г в воде массой
192 г температура повышается на 3,95 °С. Определить теплоту гидратации сульфата меди СuS04, если известно, что теплота растворения СuS04,• 5Н20 равна 11 723 Дж. Удельная теплоемкость раствора равна 4,187 Дж/(г • К).
Решение. Для нагревания раствора массой 1 г на 1 °С потребуется 4,187 Дж, а для нагревания раствора массой 200 г (8 + 192) на 3,95 °С потребуется:
4,187 • 200 • 3,95 = 3308 (Дж)
Следовательно, при растворении сульфата меди массой 8 г в воде массой 192 г выделяется 3308 Дж, а при растворении 1 моль (160 г) безводной соли выделится ∆Hбезв.
Тогда 8:160 = -3308:∆Hбезв;
∆Hбезв=-66160 (Дж).
Из уравнения (2.23) находим теплоту гидратации:
∆Нгидр = 66160 — 11723 = — 77 883 (Дж)
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

ТЕПЛОТА ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Вычисление теплоты горения составов производят на основании закона Гесса, который может быть сформулирован так: количество тепла, выделяющееся при химической реакции, зависит от начального и конечного состояния системы и не зависит от пути протекания реакции.
Из закона Гесса следует, что теплота образования из элементов продуктов горения пиротехнического состава, равна сумме теплот образования компонентов состава, к которой следует добавить количество тепла, выделяющегося при горении состава. Следовательно, теплота реакции горения определяется как разность между теплотой образования продуктов горения и теплотой образования компонентов состава.
где QГ.С. — теплота горения состава
QП.Г. — теплота образования продуктов горения состава
QК.С. — теплота образования компонентов состава
Величины теплот образования продуктов реакции находят в термохимических таблицах справочников Брицке Э.В., Капустинского А.Ф. Карапетьянц М.Х. и Карапетьянц М.Л. и других.
Пример: рассчитать теплоту горения смеси:
Теплота образования продуктов горения:
Теплота образования компонентов QК.С.= Ba(NO3)2 =237 ккал:
QК.С. ОБЩЕЕ = 237ккал • 3 = 711ккал
Теплота горения состава:
QГ.С. = 2399ккал – 711ккал = 1688ккал
Сумма по массе Ba(NO3)2 и алюминия, вычисленная по молекулярному весу:
М = 261,4 • 3 + 27 • 10 = 1054г
Теплота горения состава:
q = 1688 / 1054 = 1,601ккал/г
Приведенный метод расчета не дает представления о расходе части тепла на разложение окислителя внутри горящего состава.
Существует иной метод расчета теплоты горения, дающий представление о расходе тепла внутри горящего состава. Рассмотрим этот метод на примере смеси Ba(NO3)2 + Mg. Стехиометрический расчет дает соотношение компонентов смеси 68% Ba(NO3) и 32% Mg. Пользуясь таблицей 3, находим, что 0,32г. магния выделяют при горении 0,32 • 5,9 = 1,88ккал тепла. Из таблицы теплоты образования окислов находим, что на разложение 261г Ba(NO3)2 требуется 104ккал. Вычисляем, что на разложение 0,68 Ba(NO3)2 необходимо затратить 0,27ккал. Сопоставляя данные, получаем теплоту горения смеси q = 1,88 – 0,27 = 1,61ккал/г
В приведенном случае на разложение окислителя затрачивается 0,27 • 100 / 1,88 = 14% от теплоты горения магния. Используя такой метод расчета теплоты горения железоалюминиевого термита состава 75% Fe2O3 и 25% Al, находим, что тепловой баланс его q = 1,82 – 0,86 = 0,96ккал/г, то есть в данном случае на разложение окислителя расходуется уже 47% теплоты горения алюминия. Отсюда можно сделать вывод, подтверждающийся опытными данными, что теплота горения такого состава сравнительно мала, так как около половины тепла горения горючего расходуется на разложение окислителя.
В ниже приведенной таблице 8 приведены данные о теплоте горения некоторых пиротехнических составов составленных в стехиометрических отношениях.
Таблица 8
| Рецепт | Теплота горения [ккал/г] | Назначение состава | |
| Компонент | % | ||
| КСIO4 | 3,19 | Перспективный | |
| Be | |||
| КСIO4 | 2,45 | Зажигательный Фотосмесь | |
| АI | |||
| КСIOз | 2,29 | Фотосмесь | |
| Mg | |||
| КСIO4 | 2,24 | Фотосмесь | |
| Mg | |||
| NaNO3 | 2,00 | Осветительный (без цементатора) | |
| Al | |||
| Ba(NO3)2 | 1,65 | Фотосмесь | |
| Mg | |||
| Pb(NO3)2 | 1,48 | На практике не применяется | |
| Al | |||
| Sr(NO3)2 | 1,48 | Трассирующий | |
| Mg | |||
| Резинат кальция | |||
| KMnO4 | 1,42 | На практике не применяется | |
| Mg | |||
| Ba(NO3)2 | 1,4 | Осветительный | |
| AI | |||
| Сера | |||
| CaSO4 | 65,5 | 1,36 | Зажигательный |
| AI | 34.5 | ||
| BaSO4 | 76,5 | 1,31 | Зажигательный |
| AI | 23,5 | ||
| NH4CIO4 | 1,26 | Ракетное топливо | |
| Эпоксидная смола | |||
| Нитроглицериновый коллоидный порох | 1,23 | Ракетное топливо Метательный | |
| КСIO3 | 1,11 | Взрывчатый | |
| Уголь | 13,0 | ||
| Mno2 | 1,05 | Термит | |
| AI | |||
| Fe2O3 | 0,96 | Термит | |
| AI | |||
| KNO3 | 0,66 | Порох дымный Метательный | |
| Уголь | |||
| Сера | |||
| BaO2 | 0,61 | Трассирующий | |
| AI | |||
| C2CI6 | 0,52 | Дымовой | |
| КСIO3 | |||
| Zn | |||
| КСIO3 | 0,38 | Дымовой красного дыма | |
| Молочный сахар | |||
| Краситель родамин | |||
| БЕСКИСЛОРОДНЫЕСОСТАВЫ | |||
| CCI4 | 1,38 | Дымовой | |
| Mg | |||
| CuF2 | 0,98 | Термитный | |
| Mg | |||
| C2CI6 | 0,96 | Дымовой | |
| AI | |||
| Mg | 6,1 | Сплав «Электрон», горение за счет кислорода воздуха | |
| AI |
Составы с отрицательным кислородным балансом, в процессе горения которых участвует кислород воздуха, дают значительно большие количества тепла, чем составы из тех же компонентов, но взятых в стехиометрических соотношениях.
В качестве примера можно привести состав, состоящий из 44% KClO3 и 56% Mg с кислородным балансом n = – 20г O2, уравнение реакции горения которого:
KClO3 + 6,5Mg + 1,75O2 = KCl + 6,5MgO
Теплота горения состава 
По сравнению с приведенными в таблице теплотами горения состава из тех же компонентов, взятых в стехиометрических соотношениях получается увеличение теплоты горения на 47%.
Таблица 9. Теплоты образования(- 
| Соединение | Теплота образования [ккал/г-моль] | Соединение | Теплота образования [ккал/г-моль] |
| LiO2 | ZnO | ||
| ВеО | ZnS | ||
| MgO | К2СОз | ||
| MgF2 | |||
| АI2O3 | Нафталин С10Н8 | — 16 | |
| AIF3 | |||
| AI2S3 | Антрацен С14Н10 | — 32 | |
| CaO | |||
| ТiO2 | Крахмал CgH10O5 | ||
| TiF4 | |||
| ZrO2 | Молочный сахар C12H24O11 | ||
| ZrF4 | |||
| H2O* | 68,4 | Шеллак C16H24O5 | |
| CO2 | |||
| B2O3 | Идитол C13H12O2 | ||
| SiO2 | |||
| P2O5 | Уротропин C6H12N4 | — 30 | |
| Na2O | |||
| NaCI | Гексахлорэтан C2CI 6 | ||
| Na2CO3 |
Теплоты образования основных пиротехнических окислителей даны в таблице 1.
ГАЗООБРАЗНЫЕ ПРОДУКТЫ ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Реакция горения пиротехнических составов почти всех видов сопровождается выделением определенного количества газообразных продуктов, которые могут быть как газами (CO, СО2, N2), так и парами воды, а также и парами веществ, находящихся при температуре горения в парообразном состоянии.
Примером может служить смесь хлората калия и алюминия, горение которой протекает по реакции:
Температура реакции горения такой смеси составляет около 3000 ° С, а так как хлористый калий кипит уже при 1415 ° С, то при температуре реакции он будет находится в парообразном состоянии. Этим и объясняется тот факт, что горение подобных смесей, не выделяющих нормальных газов, может протекать взрывным образом с проявлением некоторого фугасного эффекта.
Соотношение между количеством газообразных и твердых продуктов реакции определяется назначением состава и требованиями, предъявляемыми к специальному эффекту, например, в термитных составах газообразные продукты реакции практически отсутствуют, в дымовых и имитационных звуковых составах составляют 40. 50% от массы состава и, наконец, в реактивных составах практически 100%.
Количество газообразных продуктов, получающихся в результате сгорания 1г пиротехнического состава, принято выражать не по массе, а по объему, занимаемому ими при нормальных условиях. Этот объем газообразных продуктов называется удельным объемом и обозначается через V0. Обычно, при вычислениях к объему занимаемому образующимися при реакции газами, добавляется также объем, занимаемый при нормальных условиях образующимися в процессе реакции парами воды (если она выделяется при реакции или содержится в исходных веществах в виде кристаллогидратов).
Объем Vt газообразных продуктов при температуре реакции горения вычисляют по формуле Vt = V0(1 + 0,00366t), где t — температура реакции горения состава, V0 — удельный объем.
В таблице 10 указан объем, занимаемый при нормальных условиях 1граммом газов преимущественно выделяющихся при реакциях горения.
Таблица 10.Удельный объем некоторых газов при нормальных условиях
| Газ | Объем [см 3 /г] | Газ | Объем [см 3 /г] |
| Н2 | N2 | ||
| Н2O | SO2 | ||
| C O | НСI | ||
| СО2 | СI2 |
Как видно из таблицы 10, при равной массе наибольший объем в газообразном состоянии занимает водород, а затем пары воды, азот и окись углерода.
Из этого можно сделать вывод, что для получения большего объема газов следует в качестве горючих компонентов пользоваться органическими веществами, содержащими много связанного водорода, а количество окислителя рассчитывать таким образом ,чтобы сгорание горючего происходило только до H2O и CO или, если это диктуется желанием получить больше тепла, до H2O и СО2.
Удельный объем газообразных продуктов реакции определяют по формуле:
где n — число молей газообразных продуктов реакции (сумма коэффициентов при газообразных веществах в правой части уравнения реакции),
m — масса реагирующего состава в граммах,
22,4 — число Авогадро.
Пример: рассчитать V0 для имитационного состава состоящего из хлората калия, алюминия и углерода, задавшись целью получить состав с возможно большим газовыделением и значительной теплотой горения.
Конструирование состава: зная, что наибольший объем газа в заданной смеси может дать окись углерода, запишем формулу так, чтобы входящий в состав углерод окислился только до окиси углерода:
Откуда:
Вычислив рецепт состава согласно заданной формуле получим:
Естественно, что при охлаждении газов до нормальной температуры реальное значение вычисленного удельного объема будет ниже чем расчетное, так как произойдет конденсация паров хлорида калия.
Задавшись эмпирическим значением температуры горения данного состава равным 2500 ° С, можно осуществить прикидочный расчет объема газов при температуре горения. Vt = 333(1 + 0,00366 • 2500) = 3380см 3 /г. Можно предположить наличие взрывчатых свойств у приведенного состава, учитывая значительный объем газов, выделяющихся в результате горения при данной температуре.
В таблице 11 приведены значения V0.
Таблица 11. Удельный объем газообразных продуктов реакции горения или взрыва некоторых составов.
| Назначение состава | Рецепт состава [%] | Газооб-разные продукты реакции | V0 СМ 3 /Г | Масса газов в % от массы состава |
| Фотосмесь | Ba(NO3)2 | N2 | ||
| Mg | ||||
| Фотосмесь | Ba(NO3)2 | N2 | ||
| AI | ||||
| Термит | Fe3O4 | нет | ||
| AI | ||||
| Осветительный | Ba(NO3)2 | N2, CO2, Н2О | ||
| Mg | ||||
| Идитол | ||||
| Зеленый сигнальный | Ba(CIO3)2 H2O | СО2 ,Н2O | ||
| Идитол | ||||
| Красный сигнальный | KCIO3 | СО, Н2О | ||
| SrCO3 | ||||
| Шеллак | ||||
| Красный дымовой | KCIO3 | СО, Н2О | ||
| Молочный сахар | ||||
| Родамин | ||||
| Дымный порох | KNO3 | СО, СО2 N2, H2O | ||
| С | ||||
| S | ||||
| ВВ | c 6 h 3 n 3 o 7 k | К2СO3, СО, СО2 N2, Н2O, | ||
| ВВ | C6H3N3O7NH4 | N2,H2O, CO2 | ||
| NH4NO3 | ||||
| ВВ | Пироксилин (15% влажности) | N2, H2O, СO2, СО |
Следует отметить, что удельный объем газообразных продуктов для применяемых пиротехнических составов (кроме твердых коллоидных и смесевых ракетных топлив) значительно меньше, чем для основных взрывчатых веществ. Так V0 для гексогена и октогена составляет 908cм 3 /г, для тетрила 750см 3 /г, для тротила 690см 3 /г, для смеси НТА (94%) с дизельным топливом (6%) примерно 890см 3 /г.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
💥 Видео
Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Уравнивание реакций горения углеводородовСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как расставить коэффициенты? Как превратить схему химической реакции в уравнение химической реакции.Скачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Составление уравнений реакций горения. 11 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

25. Схема реакции и химическое уравнениеСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Найдите сумму коэффициентов в правой части уравнения. H2S + H2SO4 + K2Cr2O7 = Cr2(SO4)3 + SСкачать