А
В молекулярном виде:
FeS+2HCl=FeCl₂+H₂S↑
В полном ионном виде:
FeS+2H⁺+2Cl⁻=Fe²⁺+2Cl⁻+H₂S↑
В сокращенном ионном виде:
FeS+2H⁺=Fe²⁺+H₂S↑
б
В молекулярном виде:
Ba(OH)₂+H₂SO₄=BaSO₄↓+2H₂O
В ионном виде:
Ba²⁺+2OH⁻+2H⁺+SO₄²⁻=BaSO₄↓+2H₂O
Уравнения не сокращается
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Сульфид железа 2 и соляная кислота ионное уравнение и молекулярное уравнение
- Готовые домашние задания, готовые задачи по химии и биологии
- Характеристика сульфидов. Задачи 851 — 854
- Получение и свойства сульфидов
- 📺 Видео
Видео:Химия | Молекулярные и ионные уравненияСкачать

Please wait.
Видео:Химия. Молекулярные и ионные уравненияСкачать

We are checking your browser. gomolog.ru
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7087dfe65cddfa68 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Сульфид железа 2 и соляная кислота ионное уравнение и молекулярное уравнение
Составьте уравнения указанных реакций, используя химические формулы веществ из п. 6.1.
Ниже даны словесные описания двух химических превращений с участием веществ, перечень которых был приведён в задании 6:
(1) сульфид железа(II) + соляная кислота → хлорид железа(II) + сероводород;
(2) железо + сульфат меди(II) → сульфат железа(II) + медь.
В зависимости от числа и состава веществ, вступающих в химическую реакцию и образующихся в результате неё, различают реакции соединения, разложения, замещения и обмена. Выберите ЛЮБУЮ реакцию (1) или (2) и укажите её тип.
1. Реакция (1) — реакция обмена.
2. Реакция (2) — реакция замещения.
Для реакции (1) запишите полное и сокращённое ионные уравнения.
Полное ионное уравнение:
Сокращённое ионное уравнение:
1.
2.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Готовые домашние задания, готовые задачи по химии и биологии
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Характеристика сульфидов. Задачи 851 — 854
Видео:Реакции ионного обмена. 9 класс.Скачать

Получение и свойства сульфидов
Задача 851.
Почему сульфид цинка растворяется в соляной кислоте, а сульфид меди нет? В какой кислоте можно растворить сульфид меди?
Решение:
Взаимодействие сульфида цинка с соляной кислотой выражается уравнением:
ZnS(к) + 2HCl ↔ ZnCl2 + H2S(г)
ZnS + 2H + ↔ Zn 2+ + H2S
Присутствие в числе исходных веществ малорастворимого электролита ZnS, при образовании которого связываются ионы S 2- , обуславливает протекание реакции влево. С другой стороны, при образовании слабого электролита H2S также связываются ионы S 2- , способствующие протеканию реакции вправо. Таким образом, ионы S 2- участвуют в двух процессах, приводящих к установлению двух равновесий:
S 2- + Zn 2+ ↔ ZnS(к);
S 2- + 2Н + ↔ Н 2 S(г).
Протекание того или иного процесса зависит от того, какое из двух веществ – сероводород или сульфид цинка – в большей степени связывает ионы S 2- . Константа диссоциации H2S (K = K1 . K2 = 6 . 10 -22 ), произведение растворимости ZnS равно 1,3 . 10 -23 . Из чего вытекает, что связывание ионов S 2- в молекулы H2S происходит полнее, чем в ZnS. Поэтому рассматриваемая реакция протекает вправо – сульфид цинка растворяется в соляной кислоте. Аналогично два равновесия устанавливаются в системе CuS—HCl:
S 2- +Cu 2+ ↔ CuS(к);
S 2- + 2Н + ↔ Н2S(г).
Но произведение растворимости CuS равно 3,2 . 10 -38 , что меньше, чем 6 . 10 -22 . Поэтому связывание ионов S 2- в CuS происходит полнее, чем в молекулах H2S и, равновесие в системе:
сместится влево; сульфид меди не растворим в растворе соляной кислоты. Следовательно, сульфид меди растворится в растворе той кислоты, суммарная константа диссоциации которой будет иметь меньшее численное значение, чем ПР(CuS), например, ортокремниевая кислота H4SiO4 численное значение К = К1 . К2 . К3 . К4 = 8 . 10 -48 .
Задача 852.
Каковы продукты реакции взаимодействия хлорида железа (III): а) с сероводородом; б) с сульфидом аммония?
Решение:
а) Хлорид железа (III) и сероводород реагируют с образованием хлорида железа (II), серы и хлороводорода:
Данная реакция протекает по окислительно-восстановительному механизму, где роль окислителя играет FeCl3, а восстановителя – H2S.
б) Между хлоридом железа (III) и сульфидом аммония протекает реакция по обменному механизму с образованием сульфида железа (III) и хлорида аммония:
Задача 853.
Объяснить, почему ZnS и РbS можно получить обменной реакцией в водном растворе, а Al2S3 и Cr2S3 нельзя. Указать способ получения Al2S3 и Cr2S3.
Решение:
Малорастворимые сульфиды металлов можно осадить из растворов солей действием сероводорода или сульфида аммония:
Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих элементы в высоких степенях окисления Al2S3 и Cr2S3 и др.), часто идет до конца, он необратим. Поэтому Al2S3 и Cr2S3 нельзя получить обменной реакцией в водном растворе. Обычно для их получения используют сплавление метала с серой в отсутствие кислорода и влаги:
2Al + 3S 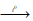
2Cr + 3S 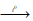
Сульфид хрома поучают:
Сплавление оксида хрома(III) с сероводородом:
2Cr2O3 + 9S 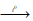
Пропускание сероводорода через нагретый оксид хрома(III):
Cr2O3 + 3H2S 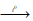
Задача 854.
Какова реакция среды в растворах: а) Na2S; 6) (NH4)2S; в) NaНS?
Решение:
а) Na2S – соль сильного основания и слабой кислоты, гидролизующаяся по аниону:
Na2S ↔ 2Na + + S 2- ;
S 2- + H2O ↔ HS — + OH — (ионно-молекулярная форма);
Na2S + H2O ↔ NaHS + NaOH (молекулярная форма).
Гидролиз преимущественно протекает по первой ступени, при этом образуется избыток ионов ОН — , которые придают раствору соли щелочную среду, рН > 7.
б) (NH4)2S – соль слабого однокислотного основания и слабой двухосновной кислоты, гидролизуется как по катиону, так и по аниону:
(NH4)2S ↔ 2NH4 + + S 2- ;
NH4 + + H2O ↔ NH4OH + H + (ионно-молекулярная форма);
S 2- + H2O ↔ HS — + NH4OH (ионно-молекулярная форма).
При гидролизе солей, образованных слабым основанием и слабой кислотой в растворе образуются в избытке как ионы Н + так и ионы ОН — , которые взаимодействуя друг с другом образуют Н2О:
Н + + ОН — ↔ Н2О
Казалось бы, реакция среды должна быть нейтральной по причине образования воды, но, на самом деле, реакция среды бывает или слабокислой, или слабощелочной, что зависит от силы кислоты и основания, образующие соль. Так, если КD основания меньше, чем KD кислоты, то гидролиз соли будет преимущественно протекать по катиону и, следовательно, в растворе будут незначительно преобладать ионы водорода Н + , что придаст раствору слабокислую среду, рН раствора будет незначительно меньше семи. Так как KD(H2S) — , что придаёт ему слабощелочную среду, рН > 7.
в) NaНS – кислая соль слабой кислоты и сильного основания, которая будет гидролизоваться по аниону:
NaHS ↔ Na + + HS — ;
HS — + H2O ↔ H2S + OH — (ионно-молекулярная форма);
NaHS + H2O ↔ H2S + NaOH (молекулярная форма).
При гидролизе гидросульфида натрия образуется избыток ионов ОН — , которые придают раствору соли щелочную среду, рН > 7.
📺 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Сокращённое ионное уравнениеСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Реакции ионного обмена. 9 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Разбор второй части. СТАТГРАД. ХимияСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать


