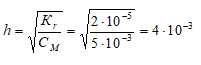- Соли цинка
- Нитрат и сульфат цинка
- Комплексные соли цинка
- Гидролиз солей цинка
- Цинкаты
- Сульфид цинка
- Гидролиз
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- 🎦 Видео
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
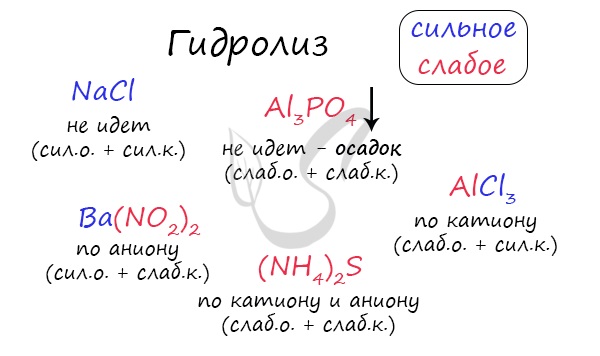
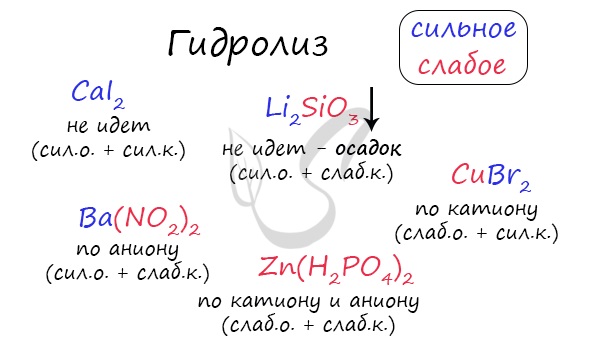
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
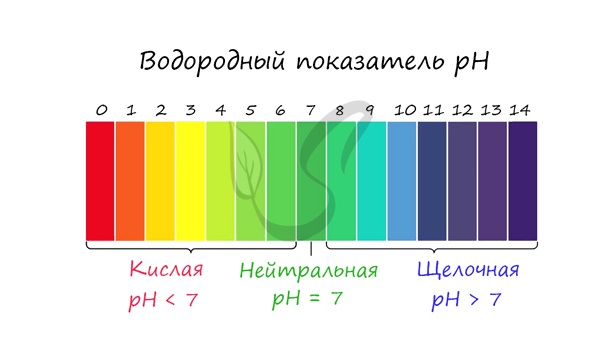
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:Гидролиз солей. 9 класс.Скачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
🎦 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Электролиз. 10 класс.Скачать

СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Реакции ионного обмена. 9 класс.Скачать

Решаем все задания на гидролиз в ЕГЭСкачать

Почекай ты меня называла 28Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Как выглядит совместный гидролиз солей на ЕГЭ - химические опыты | Химия 10 класс УмскулСкачать

Гидролиз солей.ПримерыСкачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать