Об эффективности осуществления любого промышленного процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты, себестоимость продукции и т. д. Естественно, что окончательная оценка эффективности химико-технологического процесса выводится из этих критериев. Однако они характеризуют весь процесс в целом, его конечный результат, не входя в детальное рассмотрение внутренней сущности, особенностей процесса.
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей использовать такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах технологической схемы.
В качестве таких показателей принято, прежде всего, использовать степень превращения исходного реагента, выход продукта, селективность. Они с разных сторон характеризуют полноту использования возможностей осуществления конкретной химической реакции.
Степень превращения.Степень превращения реагента показывает, насколько полно в химико-технологическом процессе используется исходное сырье.
Степень превращения – это доля исходного реагента, использованного на химическую реакцию.
Степень превращения реагента J
где nJ, 0 – количество реагента J в исходной реакционной смеси;
пJ, f– количество реагента J в реакционной смеси, выходящей из аппарата или находящейся в реакторе; ∆nJ – изменение количества реагента J в ходе химической реакции.
Чаще всего в химической реакции участвует не один, а два реагента (или даже больше). Степень превращения может быть рассчитана по первому, второму или третьему реагенту, причем в общем случае не обязательно получаются равные результаты.
Если протекает реакция (I), то в соответствии с ее стехиометрическим уравнением изменения количеств ее участников ∆nJ связаны между собой следующими соотношениями:
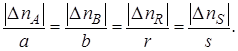
Степени превращения реагентов А и В, участвующих в реакции (I):
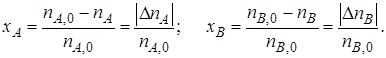
Из уравнений (1.3) и (1.4) следует
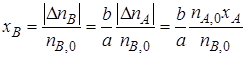
или 
Уравнение (1.5) устанавливает связь между степенями превращения реагентов А и В и позволяет рассчитать неизвестную степень превращения одного реагента, зная степень превращения другого.
Если 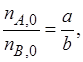
Если 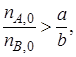
Необходимо помнить, что степень превращения – это доля первоначального количества реагента, т. е. пределы изменения х определяются соотношением
Следовательно, если один из реагентов (например, реагент В) взят в избытке, то с учетом выражений (1.5) и (1.6) всегда хВ
где nА,е – количество реагента А в условиях равновесия; | nА,е | – изменение количества реагента А к моменту наступления равновесия (максимально возможное при данных условиях осуществления химической реакции).
Используя степень превращения реагентов, можно определить количество продуктов R и S, образовавшихся в результате реакции (I), не осложненной наличием побочных взаимодействий. Изменение количества продукта реакции (I), например продукта R, в соответствии со стехиометрическими соотношениями (1.2) можно выразить через изменение количества реагента А или реагента В. Если первоначальное количество продукта R равно нулю (пR,0 = 0), то
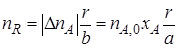
или 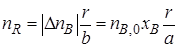
В качестве ключевого реагента, через степень превращения которого выражают количества продуктов, удобно брать реагент, взятый либо в недостатке, либо в стехиометрическом соотношении к другому реагенту. Например, если в качестве такого выбран реагент А, должно выполнятся условие
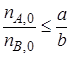
Максимально возможное количество продукта R, которое может быть получено при проведении обратимой реакции
аА+ bB 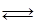
рассчитывают как равновесное количество этого продукта R, e:
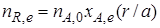
Если реакционный объем V – постоянная величина (V = const), то во всех приведенных выше соотношениях количества реагентов и продуктов могут быть заменены молярными концентрациями. Например,
Выход продукта.Степень превращения характеризует эффективность проведения процесса с точки зрения использования исходного сырья, но этой величины не всегда достаточно для характеристики процесса с точки зрения получения продукта реакции. Поэтому вводят еще один критерий эффективности – выход продукта.
Выход продукта – отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления химической реакции.
Обозначим выход продукта R через ФR. Тогда
Величина nR,max в уравнении (1.10)зависит от типа осуществляемой химической реакции. Рассмотрим несколько различных реакций.
Необратимая химическая реакция (I). Максимально возможное количество продукта R в такой реакции будет получено, если весь реагент А (nА,0) вступит в реакцию [при этом в качестве реагента А должен быть выбран такой, который удовлетворяет условию (1.8)]
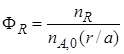
т. е. для простых необратимых реакций выход продукта и степень превращения реагента совпадают. Однако для других типов химических реакций эти два критерия эффективности различаются.
Обратимая химическая реакция (III). Для такой реакции максимально возможное количество продукта R определяется по уравнению (1.9) как равновесное количество продукта R при данных условиях осуществления реакции (температура, давление, соотношение начальных концентраций реагентов). Тогда с учетом уравнения (1.7)
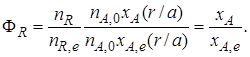
Таким образом, для обратимых реакций выход продукта равен доле, которую составляет реально достигнутая степень превращения от равновесной для данных условий проведения реакции.
Пример 1.1.Пусть протекает реакция
А + 2В 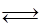
Начальное количество реагентов nА,0 = 10 кмоль; nB,0 = 25 кмоль. В реакционной смеси, выходящей из реактора, содержится 12 кмоль продукта R. Известно, что в равновесной смеси при данных условиях проведения реакции содержится 2,5 кмоль продукта А.
Определим выход продукта R (ФR). В соответствии с уравнением (1.12)
Определим степень превращения хА, используя уравнение (1.7):
Равновесная степень превращения
Параллельные и последовательные реакции. Рассмотрим две параллельно протекающие реакции, в которых наряду с целевым продуктом R получаются продукты побочной реакции:
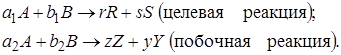
Максимально возможное количество продукта R будет получено в том случае, если весь исходный реагент А при соблюдении условия (1.8) будет реагировать только по целевой реакции. Тогда
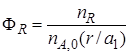
Следует помнить, что выразить nR через степень превращения и начальное количество А в случае сложной реакции нельзя, так как расходование вещества А происходит не только в целевом направлении, но и в побочном.
Так же будет выглядеть и выражение для выхода целевого продукта R для последовательных реакций, например реакций типа
aА 

При протекании обратимых параллельных и последовательных реакций максимально возможным количеством целевого продукта будет то количество R, которое было бы получено, если бы реагент А расходовался только на целевую реакцию и в момент равновесия продуктов побочных реакций не было бы.
Таким образом, для обратимых сложных реакций

Как и степень превращения, выход продукта для реакционных систем с постоянным объемом может быть определен как отношение концентраций. Следует также помнить, что выход, выражаемый как доля от некоторой предельно возможной величины, изменяется от 0 до 1.
Селективность.Выход продукта характеризует полученный результат, как долю от предельно возможного результата. Целесообразно оценить и реальную ситуацию, т. е. дать количественную оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием для такой оценки является селективность. Селективность, как и два предыдущих критерия эффективности, выражают в долях единицы или процентах.
Полная, или интегральная, селективность φ– это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую, и побочные):
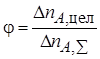
Мгновенной, или дифференциальной, селективностью φ / называют отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов:
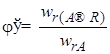
где 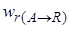
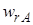
Использование дифференциальной селективности при анализе технологических процессов будет описано в гл. 3. Здесь рассмотрим только полную селективность.
Для реакций (III) полная селективность по целевому продукту R может быть выражена через количество полученного продукта R и количество реагента А, суммарно израсходованного на реакцию.
С учетом стехиометрических соотношений количество реагента А, вступившего в реакцию образования целевого продукта, равно (a/r) nR.
Тогда полная селективность
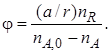
Знаменатель в уравнении (1.15) можно заменить через количество полученных продуктов целевой и побочной реакции с учетом стехиометрических соотношений:
Пример 1.2.Рассмотрим в качестве примера параллельные реакции
4NH3 + 5О2 
4NH3 + ЗО2 
Целевой является реакция получения оксида азота NO.
Селективность можно рассчитать по количеству полученных на выходе из реактора продуктов целевой реакции (оксида азота) и побочной реакции (азота):
Между выходом целевого продукта, степенью превращения исходного реагента и селективностью существует простая связь. Рассмотрим ее сначала на примере необратимых параллельных реакций (IV).
В соответствии с уравнением (1.13) выход продукта R
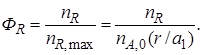
Реально полученное количество продукта R можно выразить через селективность, пользуясь уравнением (1.15)
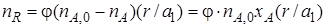
После подстановки уравнения (1.17) в уравнение (1.16) получим
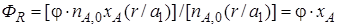
Если параллельные реакции обратимы, то максимально возможное количество продукта R, которое могло бы получиться при отсутствии побочной реакции, определяется условиями равновесия. Тогда для определения выхода продукта нужно применить уравнение (1.14). Подставляя в него значение количества реально полученного продукта R, выраженного с помощью уравнения (1.17), будем иметь более общее уравнение связи между выходом, селективностью и степенью превращения:
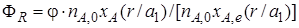

Из уравнений (1.18)и (1.19)следует, что при выборе условий проведения сложных химических реакций недостаточно обеспечить только высокое значение степени превращения реагентов или только высокую селективность; высокое значение выхода целевого продукта определяется некоторой совокупностью этих критериев эффективности.
Оптимальными значениями выхода, селективности и степени превращения будут, как правило, такие, достижение которых позволяет обеспечить максимальную экономическую эффективность процесса.
Производительность и интенсивность.Важным критерием эффективности работы отдельных аппаратов, цехов или заводов в целом является производительность.
Производительность – это количество продукта, полученное в единицу времени:
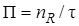
где П – производительность; nR – количество продукта; τ – время. Производительность измеряется в кг/ч, т/сут, т/год и т. д. Например, производительность современного агрегата синтеза аммиака составляет 1360 т аммиака в сутки; производительность агрегата по производству серной кислоты – 1 млн т серной кислоты в год и т. д. Иногда производительность оценивают по количеству переработанного сырья, например производительность печи обжига колчедана – 450 т колчедана в сутки. Если известны концентрация продукта в реакционной смеси, для определения производительности удобно воспользоваться следующей формулой:
где cR – концентрация продукта; v – объемный расход реакционной смеси.
Максимально возможная для данного агрегата, машины производительность (проектная) называется мощностью. Одним из основных направлений развития химической промышленности является увеличение единичной мощности агрегатов, так как оно ведет к снижению удельных капитальных затрат, повышению производительности труда.
Для сравнения работы аппаратов различного устройства и размеров, в которых протекают одни и те же процессы, используют понятие «интенсивность».
Интенсивностью называется производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, – его объему, площади поперечного сечения и т. д.
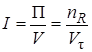
где V – объем аппарата. Интенсивность измеряется в кг/(ч · м 3 ), т/(сут · м 3 ) и т. д.
При разработке новых процессов или усовершенствовании существующих стремятся к созданию высокоинтенсивных аппаратов. Увеличение интенсивности аппарата часто возможно при создании таких условий проведения процесса, которые обеспечивают его протекание с высокой скоростью.
При анализе работы каталитических реакторов принято относить производительность аппарата в целом к единице объема или массы катализатора, загруженного в реактор. Такую величину, численно равную количеству продукта, полученного с единицы объема или массы катализатора, называют производительностью катализатора, или его напряженностью.
Вопросы и упражнения для повторения и самостоятельной работы
1. Из каких основных стадий состоит химико-технологический процесс? В каких стадиях химико-технологического процесса участвуют химические реакции?
2. Что такое химический процесс? Почему химический процесс как единичный процесс химической технологии сложнее по сравнению с тепловыми и массообменными процессами?
3. Объясните взаимное влияние химической реакции и явлений тепло- и массопереноса на примерах:
а) сгорание в потоке воздуха частицы колчедана;
б) разложение фторапатита Ca5F(PO4)3 серной кислотой;
в) получение аммиачной селитры при взаимодействии газообразного аммиака с раствором азотной кислоты.
4. Какие технологические критерии эффективности химико-технологического процесса вы знаете? Дайте их определения.
5. Каковы пределы изменения степени превращения, выхода продукта, селективности?
6. Что означает выражение «реагенты взяты в стехиометрическом соотношении»?
7. Выведите уравнение связи между степенями превращения двух реагентов, вступающих в реакцию
аА + bВ 
8. В химической реакции участвуют два реагента А и В, причем на каждый моль реагента А взято по 2 моль реагента В. В каком случае будет справедливо утверждение, что степень превращения хА реагента А больше степени превращения хВ реагента В?
9. В чем различия между действительной и равновесной степенями превращения реагента?
10. С какой целью при проведении химических процессов в промышленных условиях один из реагентов часто берут в избытке по отношению к стехиометрии реакции? Каковы пути использования реагента, взятого в избытке и не вступившего в реакцию?
11. Определите состав смеси (сА, сВ, cR, cS) и степень превращения jcb для реакции А + 2В 
сB,0 = 1,5 кмоль/м 3 .
12. Выведите уравнение связи между выходом продукта и степенью превращения одного из реагентов для обратимой химической реакции, не сопровождающейся побочными взаимодействиями.
13. Рассчитайте выход продукта Р, если известно, что при проведении последовательных реакций
А+ В 
Р + М 
получено 12 моль продукта Р, 4 моль продукта S, а для проведения реакций было взято по 20 моль реагентов А и В.
14. В чем различие между полной (интегральной) и мгновенной (дифференциальной) селективностями?
15. Выведите уравнение взаимосвязи между выходом целевого продукта R, степенью превращения реагента А и полной селективностью φ при проведении двух необратимых последовательных реакций
А 
R 
16. Выведите уравнение взаимосвязи между выходом целевого продукта, степенью превращения реагента и полной селективностью при проведении параллельных обратимых реакций
а1А + b1В 
a2А + b2B 
17. Рассчитайте полную селективность, если при проведении последовательных реакций
A 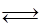
R 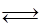
получено 6 моль продукта R и 2,5 моль продукта S.
18. Протекают последовательные реакции А 

19. Определите выход продукта R и степень превращения хА реагента А, если обратимая реакция А 
20. Протекают параллельные реакции
2А 
А 
Определите выход продукта R, степень превращения хА реагента А и полную селективность φ, если на выходе из реактора сА,f = 2 кмоль/м 3 , cR, f = 3 кмоль/м 3 , cS, f = 3,5 кмоль/м 3 .
21. Что называется производительностью, мощностью, интенсивностью?
22. Как связаны между собой:
а) производительность и степень превращения реагента;
б) производительность и выход целевого продукта?
23. Определите понятия «технологический режим», «технологическая схема процесса».
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Расчет степени превращения и состава равновесной смеси
Расчет степени превращения и состава равновесной смеси
Значение константы равновесия позволяет рассчитать состав равновесной смеси, т. е. определить максимально возможный, или теоретический выход продукта.
Константа равновесия определяет степень завершенности реакции. Чем больше константа равновесия, тем больше в равновесной смеси продуктов реакции. При Кр ® µ в равновесной смеси будут только продукты реакции, следовательно, реакция завершена полностью.
Состав равновесной смеси можно определить двумя способами:
Ø по степени завершенности реакции и
Ø по закону сохранения массы элементов при реакции.
Степень завершенности реакции выражается следующими характеристиками:
ü мерой реакции,
ü степенью превращения,
ü степенью диссоциации.
Количества веществ изменяются в реакции не одинаково, а пропорционально их стехиометрическим количествам.
Величиной, характеризующей изменение количества участников реакции, является мера реакции:
ni — число моль i-го компонента в равновесной смеси;
Ni — число моль i-го компонента в исходной смеси.
В соответствии с этим:

Величину b называют еще пробегом реакции.
Число моль i-го компонента в равновесной смеси равно:


— это доля реагента, которая превращается к моменту достижения равновесия при данных условиях:

Перепишем уравнение (1) в виде:
где 
Знак «-» означает, что концентрация реагента А уменьшается.
С учетом последнего уравнения преобразуем уравнение (2):

Физический смысл величин Li и li:
— доля вещества, которая продиссоциировала к моменту равновесия:
Очевидно, что степень диссоциации является степенью превращения вещества C в реакции диссоциации: a = ХC.
Поэтому можно записать:

Связь константы равновесия с мерой реакции, степенью превращения и степенью диссоциации в каждом конкретном случае разная и зависит от вида уравнения.
Константу равновесия, выраженную через парциальные давления и концентрации реагентов можно представить в виде:

Парциальные давления и концентрации равны соответственно:
где p — общее давление,


Используя уравнение состояния:


Число моль каждого вещества можно выразить через меру реакции, степень превращения и степень диссоциации по уравнениям (2), (4) и (5). Таким образом:
Следовательно, при постоянном давлении уравнения позволяют определить степень завершенности реакции (a, b, Х) и установить влияние давления или объема от них.
Имея значения степени завершенности реакции можно определить числа моль всех веществ, т. е. состав равновесной смеси.
Определение состава равновесной смеси по степени завершенности реакции
Рассмотрим в общем виде связь меры реакции и степени завершенности с константой равновесия.
Дана реакция, протекающая в газовой фазе:
В соответствии с уравнением (2) числа моль каждого из веществ в равновесной смеси равны:
Общее число моль всех веществ равно:
На основе уравнения (6) можно записать:

При постоянной температуре константа равновесия является постоянной величиной и уравнение (11) выражает зависимость меры реакции от давления b = f(p).
Зная Ni, nI и давление можно определить меру реакции b, а следовательно, и число моль всех веществ в равновесной смеси на основе уравнений (10).
Аналогичные уравнения можно получить с использованием степени превращения.
Число моль веществ A, B, C, D и инерта в равновесной смеси можно выразить, используя уравнение (4):
Общее число моль всех веществ в равновесной смеси равно:

В этом случае уравнение (6) для константы равновесия выглядит следующим образом:

При постоянной температуре это уравнение (14) представляет собой зависимость степени превращения от давления X = f(p).
Используя уравнение (8) запишем:

При составлении уравнений для константы равновесия используют следующие приемы.
Пусть исходная смесь содержит 60 % водорода, 20 % азота и 20 % инертного газа. В результате реакции образовался аммиак при давлении 50 бар и конечной температуре 673°К. Определить максимальное количество (в %) водорода, превращающегося в аммиак и содержание аммиака (в %) в образованной смеси. КР = 0,0125 (для данных условий).
Примем, что в исходной смеси 100 кмоль. Тогда:
Равновесный состав газовой смеси можно выразить, обозначая через х степень превращения одного из исходных реагентов.
Долю водорода превращающегося в NH3 обозначим через х.
Число моль веществ в равновесной смеси на основе уравнения (12):
запишется следующим образом:
Общее число моль (кмоль) в равновесной смеси в соответствии с уравнением (13) равно:
Подставляя соответствующие величины в уравнение (6) или (11), получим:
Это уравнение можно решить методом итераций (последовательных приближений). Разность между двумя сторонами уравнения должна быть равна нулю при правильном значении х. Последовательные подстановки дают следующие значения разности:
Отсюда, количество водорода превращающего в аммиак равно 21,9 %.
Количество аммиака в равновесной смеси составит:
При стехиометрическом соотношении исходных веществ, количество одного из них принимают равным определенной величине, например, 1 моль, а равновесную степень превращения его обозначают через Х. Тогда в соответствии с уравнением реакции можно выразить равновесный состав смеси и написать уравнение для константы равновесия через число моль веществ, участвующих в реакции.
за исходный состав можно принять 1 моль азота и, соответственно, 1 моль кислорода. Если степень превращения азота (или кислорода) Х, то в равновесной газовой смеси будет содержаться:
Сумма числа молей:
Так как в результате протекания реакции сумма числа молей компонентов не меняется, т. е. Dn = 2 — 1 — 1 = 0, то
Зная величину константы равновесия, из последнего выражения определяют равновесную степень превращения X, а по ней — равновесный состав газовой смеси.
Выражения, связывающие константу равновесия некоторых наиболее распространенных типов реакций с равновесной степенью превращения, приведены в таблице 1.
Таблица 1. Выражения КР для некоторых типов реакций
Вид уравнения для КР
Вид уравнения для КР
Определение состава равновесной смеси на основе закона сохранения массы элементов
В этом случае состав равновесной смеси определяется на основе совместного решения системы уравнений, включающей
ü уравнение баланса атомов элементов до и после реакции
ü уравнение для константы равновесия данной реакции
Запишем общую методику составления системы уравнений для определения состава равновесной смеси.
Пусть вещества, участвующие в реакции, В1, В2 …Вi состоят из атомов разного сорта А1, А2 …Aj.
Число химических элементов, как правило, меньше числа веществ на единицу.
Исходная смесь веществ (до реакции):
Равновесная смесь веществ (после реакции):
Количество атомов элемента А1 во всех веществах до реакции:
Количество атомов элемента А1 в равновесной смеси (после реакции):
На основе баланса 

Аналогичные уравнения можно записать для элементов А2, А3 и т. д.
Число уравнений равно числу элементов Aj, число веществ Bi на единицу меньше.
Уравнением, замыкающим систему, является уравнения для константы равновесия:

Решая совместно систему уравнений (16) и (17) можно определить состав равновесной смеси (
Число моль инертного газа nИ необходимо учитывать в сумме общего числа моль åni равновесной смеси в уравнении (17), если åni ¹ 0.
Рассмотрим решение предыдущего примера на основе закона сохранения массы элементов.
Состав исходной смеси:
Состав равновесной смеси:
На основе уравнения (16) запишем:


По уравнению (21) запишем:

Из уравнений (а) и (б) можно выразить 


Подставим эти величины в уравнение (в) р = 50 бар:
Отсюда
Содержание аммиака (%) в равновесной смеси равно:
Результат получается тот же, что и при использовании для расчетов степени превращения Х для водорода.
Замечу, что при определении состава равновесной смеси с помощью меры реакции, степени превращения и степени диссоциации решается одно уравнение. Полученное значение степени завершенности подставляется в уравнение, связывающее меру реакции, степени превращения и степень диссоциации с числом моль отдельных веществ в равновесной смеси.
В методе материального баланса элементов необходимо решить несколько уравнений, число которых равно числу веществ, участвующих в реакции.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Степень превращения реагента рассчитывается из уравнения
Репетитор по химии и биологии
Богунова В.Г.
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
Диплом II степени
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии
4.5 Избыток-недостаток, степень превращения, выход реакции в смеси газов
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Совсем немного прошло времени, а я уже соскучилась по своим читателям. Как вы там? Справляетесь с задачами, которые я вывалила на вас в большом количестве? Давайте, не подведите! Вы должны подготовиться к ЕГЭ фундаментально и сдать на 100 баллов! Хотите, чтобы ваше самое сокровенное желание исполнилось? Произнесите волшебное заклинание: «Трах-тибидох-тибидох!» и стукните правой ногой три раза по полу. Ждать исполнения желания осталось недолго. Как только решите все задачи, которые я для вас написала в статье, желание исполнится обязательно! Кстати, в конце статьи я даю рецепт колдовского кекса, который можно приготовить за 5 минут. И вкусно, и полезно, и волшебно! Читайте, решайте, готовьте, кушайте!
Однако, вернемся к основной теме. В статье «Секретная шпаргалка по химии. 4.3. Горение смеси газов» я рассказала о гипотетических (предполагаемых) алгоритмических приемах для 28 задания ЕГЭ и подробно описала первую фишку:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по участникам процесса горения (задачи на систему уравнений с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения, выход реакции
4) Задачи на изменение объема смеси газов в процессе реакции
В статье «Секретная шпаргалка по химии. 4.4. Смеси газов и уравнения с двумя неизвестными» я рассказала о второй предполагаемой фишке «Определение объемного состав смеси по участникам процесса горения (задачи на систему уравнений с двумя неизвестными)».
Сегодня речь пойдет о третьей предполагаемой фишке: «Оп ределение состава смеси продуктов-газов, если в условии избыток-недостаток, степень превращения, выход реакции» .
Это достаточно интересные задачи, в которых я покажу один из авторских приемов оформления и решения задач на газы. Рабочее название этого приема «До реакции — После реакции». Мы поучимся работать с таблицами — составлять таблицу, делать расчеты прямо в таблице, анализировать полученные результаты. Итак, поехали!
2 л метиламина смешали с 6 л кислорода (н.у.) и подожгли. Определить плотность и объем (н.у.) образовавшихся газов
Задачу решаем стандартно, по Четырем Заповедям
• Первая Заповедь . Выписать данные в разделе «Дано»
• Вторая Заповедь . Написать уравнение реакции.
При написании реакции, не забываем, что при обычном сжигании атомы элемента азота (в реагенте) превращаются в простой газ азот. Оксид азота образуется только при температуре выше 3000°С или при каталитическом окислении. Расстановку коэффициентов начинаем с азота. Для дальнейших расчетов сделаем отступ над реакцией.
• Третья Заповедь . Сделать предварительные расчеты.
Определяем избыток-недостаток. Расчеты по уравнению реакции проводим по недостатку. Выписываем рассчитанные значения в таблицу «До реакции — После реакции». В таблице хорошо видны все участники процесса, кроме того, по таблице удобно проводить различные расчеты.
• Четвертая запов едь. Составить алгоритм решения задачи.
Алгоритм решения составляем по вопросам задачи: «Определить плотность и объем (н.у.) образовавшейся газовой смеси». Объем смеси образовавшихся газов хорошо виден по таблице.
• Плотность газа (абсолютная) — определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа — масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
В указанной выше статье я также рассматривала понятие средней молярной массы. Напомню:
• Средняя молярная масса газа — рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
В данной задаче плотность газа рассчитываем по средней молярной массе, которую определяем по формуле суммы произведений объемных долей каждого газа и их молярных масс.
Решим еще парочку задач на закрепление алгоритма.
Определить состав газовой смеси, образовавшейся при смешивании 60 мл СО, 40 мл NO и 120 мл воздуха.
Маленький комментарий. Монооксид азота реагирует с кислородом самопроизвольно, поэтому при смешивании газов, монооксид азота прореагировал с кислородам воздуха. Далее задачу решаем по аналогии с предыдущей. Кислород «извлекаем» из воздуха по формуле объемной доли. Мы должны помнить, что объемная доля кислорода в воздухе 20% (более точно, 21%).
Приготовили 2000 л (н.у.) эквимолярной смеси метана и углекислого газа и привели ее к условиям реакции. Степень превращения метана 15%. Определите объемные доли компонентов в образовавшейся смеси газов (н.у.)
Маленький комментарий. В более ранних статьях я рассказывала, как решать задачи на избыток-недостаток «Секретная шпаргалка по химии. 3.4 Избыток-недостаток» и выход реакции «Секретная шпаргалка по химии. 3.5 Выход реакции» Сегодня мы познакомимся с понятием Степень превращения.
Степень превращения — это доля реагента, вступившего в реакция, рассчитывается как отношение количества реагента, который вступил в реакцию, к его исходному количеству. Степень превращения может быть разная для разных реагентов!
Немного расскажу о самой реакции. Это, так называемая, углекислотная конверсия метана в синтез-газ (угарный газ + водород) — одна из важнейших химических реакций. Ее используют для получения водорода и для синтеза углеводородов (жидкое топливо).
Эквимолярное соотношение — равные количества веществ. Одинаковые количества вещества газов могут быть только в одинаковых объемах. Это следует из закона Авогадро:
В равных объемах различных газов, измеренных при одинаковых условиях, содержится одинаковое число молекул.
Задача решается стандартно с учетом степени превращения.
После пропускания стехиометрической смеси водорода и азота через контактный аппарат определили, что прореагировало 12% азота. Рассчитайте степень превращения водорода и содержание компонентов в образовавшейся смеси.
Задача решается аналогично предыдущей. Стехиометрическое соотношение — количества веществ в соответствии с коэффициентами в уравнении реакции
Если вы решали задачи вместе со мной, для вас — замечательный рецепт Колдовского Кекса, который готовится за 5 минут в микроволновке. Если вы приготовите такой кекс и угостите им любимого учителя, он одарит вас особо эмоциональным объяснением новой темы. Хотя, вы не успеете угостить учителя, такой вкусный кекс вы съедите сами молниеносно!
Рецепт Колдовского Кекса (можно кушать только особо одаренным)
Масло растительное — 1,5-2 ст. л.
Разрыхлитель — 1/4 ч. л.
В небольшой миске смешать жидкие ингредиенты, затем добавить к ним сухие. Все тщательно перемешать. Кружку объемом 500 мл смазать растительным маслом. Вылить жидкое тесто в кружку и поставить в микроволновку на 1,5 минуты при высокой мощности. Достать и кушать. Можно полить сметаной или йогуртом. Отличный завтрак или полдник. Приятного аппетита!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
🌟 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химическое равновесие. Закон действующих масс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Задачи на степень диссоциации.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

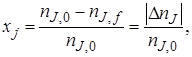
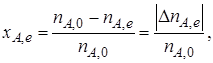
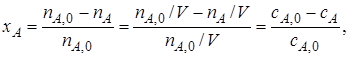
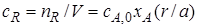
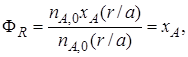

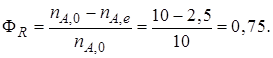
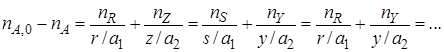
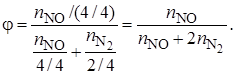



































































m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
m(2).jpg)
_m.jpg)


m.jpg)
_m.jpg)
_1.jpg)
_02.jpg)
_04.jpg)
_2.jpg)
_0.jpg)
_3.jpg)
_4.jpg)