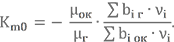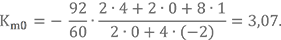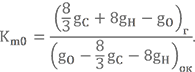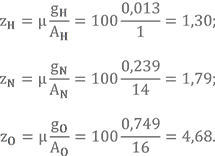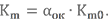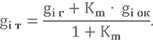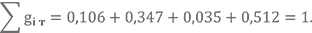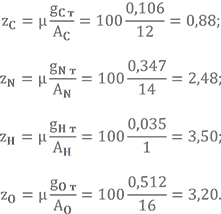Просто о том, что кажется сложным
Видео:Горение. 7 класс.Скачать

Урок 02. Определение параметров топлива (ч.1)

В сегодняшнем уроке мы узнаем, как определить стехиометрическое соотношение компонентов и записать условную химическую формулу топлива.
Во-первых, давайте вспомним, что же это такое – стехиометрическое соотношение компонентов топлива. Оказывается, топливо может гореть по-разному. Причем не нужно воспринимать это горение как обычное горение дров в камине, где в качестве окислителя выступает кислород воздуха. Горение топлива в камере ракетного двигателя – это, в первую очередь, химическая реакция окисления с выделением тепла. А протекание химических реакций существенно зависит от того, сколько вещества вступает в реакцию. Если взять 1 кг какого-нибудь горючего и заставить его взаимодействовать с очень большим количеством окислителя, то после того, как этот 1 кг горючего закончится, химическая реакция горения прекратится, потому что окислителю просто нечего будет окислять.
Вопрос на засыпку.
На защите курсового проекта у студента спрашивают: что произойдёт с горючим, впрыскиваемым через пояс завесного охлаждения перед критическим сечением камеры? Распространённый ответ: оно сгорит. Это неверно. Ему не с чем там гореть. Весь окислитель уже прореагировал в камере сгорания. Горючее испарится, может разложиться, но сгореть не может.
Значит, для каждой топливной пары существует вполне определённое соотношение между количеством окислителя и горючего, при котором они взаимодействуют друг с другом без остатка. Именно такое соотношение называют стехиометрическим.
Количество компонента можно задать объёмом или массой. При расчёте топлив больше распространено массовое соотношение компонентов Km (индекс m как раз и указывает на это). Для обозначения стехиометрического соотношения добавляют индекс 0, т.е. – Km0. Каждая топливная пара имеет вполне определённое Km0. Его можно найти в справочной литературе. Однако в учебно-познавательных целях давайте рассмотрим, как его можно вычислить.
Значение Km0 зависит от валентности, которую могут проявлять химические элементы в теоретической форме уравнения химической реакции
Ну начинается – скажете Вы – опять формулы. Ну, куда же без них. На самом деле, если разобраться, то как бы и ничего сложного:
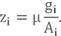
μок и μг – молекулярные массы окислителя и горючего (мы их уже считали в прошлом уроке);
bi – число грамм-атомов химического элемента в веществе, т.е. фактически количество атомов в химической формуле (грамм-атом – устаревшая единица измерения количества вещества);
νi – валентность элемента (νH = +1, νC = +4, νN = 0, νO = -2).
Возьмём топливную пару НДМГ + АТ и вычислим для неё Km0. Молекулярную массу НДМГ и АТ мы уже считали:
μ(C2N2H8) = 12·2 + 14·2 + 1·8 = 60 а.е.м.
μ(N2O4) = 14·2 + 16·4 = 92 а.е.м.
Количество атомов и валентности элементов известны. Подставляем в формулу
Но это наиболее общая формула. Она годится для любых веществ, но неудобна, если компонент представляет собой смесь. Придётся дополнительно определять его условную химическую формулу чтобы узнать bi.
Для определения Km0 при сгорании углеводородных топлив в учебнике Штехера, например, предлагается использовать более практичную формулу (для веществ, содержащих только C, H, N, O)
Найдём стехиометрическое соотношение компонентов для той же топливной пары НДМГ + АТ, но по другой формуле.
Массовые доли элементов в НДМГ были найдены в прошлом уроке gC = 0,400, gN = 0,467, gH = 0,133.
Для азотного тетраоксида gN = 0,304, gO = 0,696 (предлагаю Вам посчитать их самостоятельно).
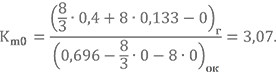
Вроде бы сошлось. 🙂
Если Вам всё же больше нравится первый вариант, то компонент нужно представить в виде условной химической формулы. При этом задаться условной молекулярной массой смеси (например, μ = 100 а.е.м.).
Количество атомов в формуле можно определить так:
Определим условную химическую формулу АК-20, рассмотренного в прошлом уроке.
Массовые доли gH = 0,013, gN = 0,239, gO = 0,749.
Получить условную химическую формулу топлива можно тем же способом.
Для определения массовых долей компонентов в топливе в целом нужно знать действительное соотношение компонентов Km. Прежде чем его вычислить, скажем несколько слов о такой величине, как коэффициент избытка окислителя αок.
Несмотря на то, что казалось бы сжигать компоненты при стехиометрии наиболее выгодно, по ряду причин реальные ЖРД обычно работают с некоторым избытком горючего (рассказ о причинах займёт довольно много времени, возможно этому вопросу будет посвящена отдельная статья в Базе знаний). Для различия между стехиометрическим и действительным соотношением компонентов топлива и вводится αок.
Зависимость крайне проста
Коэффициент может принимать любые положительные значения. Если αок = 1, Km = Km0, при αок 1 – избыток окислителя.
Узнать наперед какое значение αок лучше выбрать, очень сложно. Поэтому им либо задаются из диапазона рекомендуемых значений, либо проводят серию тепловых расчетов при разных αок, а затем выбирают оптимальное, например, из условия максимума скорости истечения продуктов сгорания на срезе сопла.
Зная значение коэффициента избытка окислителя, можно определить массовый состав топлива:
Определим массовый состав топливной пары НДМГ + АТ при αок = 0,91 и запишем её условную химическую формулу.
Значение Km0 получено в примерах выше. Массовые доли химических элементов в компонентах тоже уже известны.
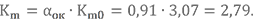
Количество атомов в условной химической формуле
На этом всё. Надеюсь, урок был полезным. В следующий раз поговорим об энтальпии топлива и плотности смесей.
Видео:Горение топлива и выделение энергии. 8 класс.Скачать

Реакции горения газа. Стехиометрическое соотношение. Коэффициент избытка воздуха
Горение — быстропротекающая химическая реакция соединения горючих компонентов с кислородом, сопровождающаяся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания. Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества(Стехиометрический состав горючей смеси (от греч. stoicheion — основа, элемент и греч. metreo — измеряю) — состав смеси, в которой окислителя ровно столько, сколько необходимо для полного окисления топлива).
Высокотемпературное горение углеводородов имеет весьма сложный характер и связано с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений, поэтому для описания процесса горения, как химической реакции, используют общее уравнение реакции горения углеводородов.
Общее уравнение реакции горения любого углеводорода:
где m, n — число атомов углерода и водорода в молекуле; Q — тепловой эффект реакции, или теплота сгорания. Тепловой эффект (теплота сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м 3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (около 2400 кДж/кг).
Для инициирования реакций горения нужны условия воспламенения смеси топлива с окислителем. Воспламенение может быть самопроизвольным и вынужденным (зажигание).
Температура самовоспламенения — минимальная температура, при которой в нагретой газовоздушной смеси начинается самопроизвольный (т. е. без внешнего подвода теплоты) процесс горения, за счет выделения теплоты горящими частицами газа.
Температура самовоспламенения не является фиксированной для данного газа и зависит от многих параметров: его содержания в газовоздушной смеси, степени однородности смеси, формы и размеров сосуда, в котором смесь нагревается, быстроты и способа ее нагрева, каталитического влияния стенок сосуда, давления, под которым находится смесь. Точный учет перечисленных факторов весьма сложен, поэтому на практике, например, при оценке взрывоопасности, пользуются экспериментальными данными.
Пределы воспламеняемости и взрываемости. Коэффициент избытка воздуха. Стехиометрические соотношения.
Газовоздушные смеси могут воспламеняться (взрываться) только тогда, когда содержание газа в смеси находится в определенных (для каждого газа) пределах. В связи с этим различают нижний и верхний концентрационные пределы воспламеняемости.
Нижний предел соответствует минимальному, а верхний — максимальному количеству газа в смеси, при которых происходит воспламенение (при зажигании) и самопроизвольное (без притока тепла извне) распространение пламени (самовоспламенение). Эти же пределы соответствуют и условиям взрываемости газовоздушных смесей.
Если содержание газа в газовоздушной смеси меньше нижнего предела воспламеняемости, такая смесь гореть и взрываться не может, поскольку выделяющейся вблизи источника зажигания теплоты для подогрева смеси до температуры воспламенения недостаточно. Если содержание газа в смеси находится между нижним и верхним пределами воспламеняемости, подожженная смесь воспламеняется и горит как вблизи источника зажигания, так и при удалении его. Такая смесь является взрывоопасной. Чем шире будет диапазон пределов воспламеняемости (называемых также пределами взрываемости) и ниже нижний предел, тем более взрывоопасен газ. И, наконец, если содержание газа в смеси превышает верхний предел воспламеняемости, то количества воздуха в смеси недостаточно для полного сгорания газа.
Существование пределов воспламеняемости вызывается тепловыми потерями при горении. При разбавлении горючей смеси воздухом, кислородом или газом тепловые потери возрастают, скорость распространения пламени уменьшается, и горение прекращается после удаления источника зажигания.
Пределы воспламеняемости сложных горючих газов, не содержащих балластных примесей, определяются по правилу аддитивности:
где Lг — нижний или верхний предел воспламеняемости сложного газа в газовоздушной или газокислородной смеси, об. %; r1, r2, …, rn — содержание отдельных компонентов в сложном газе, об. %; r1 + r2 + … + rn = 100%; l1, l2, …, ln — нижние или верхние пределы воспламеняемости отдельных компонентов в газовоздушной.
При наличии в газе балластных примесей пределы воспламеняемости могут быть определены по формуле
где LБ — верхний и нижний пределы воспламеняемости смеси с балластными примесями, об. %; Lг — верхний и нижний пределы воспламеняемости горючей смеси, об. %; Б — количество балластных примесей, доли единицы.
При расчетах часто необходимо знать коэффициент избытка воздуха α при разных пределах воспламеняемости а также давление, возникающее при взрыве газовоздушной смеси. Коэффициент избытка воздуха, соответствующий верхнему или нижнему пределам воспламеняемости, можно определить по формуле:
где Vт — теоретический расход воздуха, м 3 /м 3 .
Реакции, которых коэффициент избытка воздуха, равен единице, называются стехиометрическими.
Видео:Энергия топлива, удельная теплота сгорания топлива. 8 класс.Скачать

Основы теории горения топлива
Процессом горения называется реакция соединения вещества с кислородом, сопровождающаяся интенсивным тепловыделением.
В результате процесса горения скрытая химическая энергия топлива переходит в тепловую энергию. Для успешного проведения процесса горения необходимо создать определенные условия.
Горение топлива производится в атмосферном воздухе, который содержит;
— в объемном соотношении — 21 % 02 и — 79 % Ы2 (включая ряд других газов и примесей);
— в весовом соотношении 23,2 % 02 и 76,8 % И2.
Поэтому в продуктах сгорания всегда присутствует азот, а при горении топлива с избытком воздуха — кислород.
Стехиометрические уравнения реакций горения топлива
В процессе горения принимают участие только горючие составные части топлива. При этом происходят следующие химические процессы;
1) Реакция горения углерода;
2) Реакция горения водорода;
3) Реакция горения серы;
Аналогичные молярные, весовые а так же объемные соотношения можно написать для реакций горения остальных горючих элементов
Приведенные стехиометрические уравнения являются итоговым результатом и не отражают всей сложности механизма реакции горения.
Горение топлива может быть полным — с образованием негорючих продуктов (С02, Н20 и Б02) и неполным, когда в составе продуктов сгорания присутствуют СО, СН4, Н2 и углеводороды СтНп.
Обычно показателем неполного сгорания топлива является присутствие в продуктах сгорания топлива окиси углерода — СО.
Теоретическое и действительное количество воздуха:
Теоретическое количество воздуха, необходимое для полного сжигания 1 кг топлива, может быть рассчитано из стехиометрических уравнений горения.
Количество кислорода, необходимое для сгорания 1 кг мазута, за вычетом кислорода, содержащегося в самом топливе, определяется по формуле;
¥0 = 1,866 — + 0,7 — + 5,6 Н
2 ‘ 100 ‘ 100 ‘ 100 100р0г
Учитывая, что в воздухе содержится -21 % кислорода, получим теоретическое количество воздуха, необходимого для сжигания 1 кг мазута;
V0 = -°^ = 0,0889 Ср + 0,375Бр)+ 0,265Нр -0,03330р
Обычно величина V0 может быть оценена с достаточной точностью по эмпирической формуле;
Действительное количество воздуха, необходимого для сжигания 1кг топлива, всегда больше теоретического. Отношение действительного подведенного количества воздуха к теоретически необходимому для сжигания топлива называется коэффициентом избытка воздуха;
На практике это значение может достигать;
— для главных котлов — а = 1,1 ^ 1,2
— для современных котлоагрегатов — а = 1,03 ^ 1,05
— для вспомогательных котлов — а = 1,2 ^ 2,0
Коэффициент избытка воздуха зависит от ряда факторов; совершенства организации топочного процесса, аэродинамических характеристик топки, качества распыливания топлива, рода топлива и т. д.
Снижение коэффициента избытка воздуха всегда приводит к неполноте сгорания топлива, что в свою очередь способствует уносу частичек топлива вместе с дымовыми газами и снижает КПД котла. Повышение ^ приводит к затратам тепла (и топлива) на нагревание «лишнего» воздуха, поступающего в топку котла и также снижает КПД котлоагрегата.
Внешними признаками качественного горения топлива являются;
— оптимальное для данной нагрузки котла соотношение «топливо — воздух» при бездымном горении;
— равномерное горение без взрывов, хлопков, вибраций фронта котла;
— отсутствие в дымовых газах СО и соответствие значения С02 значению в формуляре котла;
— отсутствие коксования топлива на кирпичной кладке и поверхностях нагрева;
— отсутствие догорания топлива в газоходах.
Оценка качества горения только по отсутствию дымления может привести к грубым ошибкам, так как бездымное горение может быть реализовано в широком диапазоне коэффициентов избытка воздуха от 1,2 до 2 и более. Косвенно судить о качестве процесса горения можно по цвету пламени. При нормальном горении топлива цвет факела должен быть яркого соломенно-желтого или светло-оранжевого цвета. Красный или темно-оранжевый цвет факела с появляющимися темными полосами и черным дымом из дымовой трубы говорит о низком значении коэффициента избытка воздуха, ярко-белый цвет факела с отдельными искрами и появлением белого дыма из дымовой трубы означает избыток подаваемого воздуха.
При теплотехнических испытаниях котла, проводимых с целью определения его показателей, всегда определяют коэффициент избытка воздуха по результатам анализа дымовых газов. При этом обычно пользуются следующими формулами;
TOC o «1-5» h z 1 21,8 1
А =___________ ___ ____ _____ а=——————— —— • а =
(Я02 + 02)-СО ’ 2 2 21И2
где; ^О2, О2, СО, Ы2 — процентные содержания соответственно;
Трехатомных газов (Я02, С02 и аналогичных), кислорода, окиси углерода и азота в продуктах сгорания, определяемые с помощью газоанализаторов при работе котла. Определение суммарной концентрации трехатомных газов происходит из-за того, что газоанализатор не может определять концентрации этих газов по отдельности, а показывает суммарную их концентрацию.
Для определения коэффициента избытка воздуха по последней формуле необходимо сначала определить содержание в сухих газах ЯО2 и О2, а содержание N находят как N = 100
При эксплуатации котла для определения коэффициента избытка воздуха можно пользоваться приближенной формулой;
Энтальпия продуктов сгорания.
В топке парового котла при сжигании топлива выделяется тепло, которое передается продуктам сгорания и идет на повышение их температуры. При движении продуктов сгорания через поверхности нагрева происходит процесс передачи тепла от газов к воде и пару. При этом температура продуктов сгорания уменьшается.
Тепловое состояние продуктов сгорания характеризуется их энтальпией, которая является основным параметром тепловых эффектов в процессах подвода и отвода теплоты.
Энтальпией продуктов сгорания называется количество теплоты, необходимое для нагревания продуктов сгорания, образовавшихся при сжигании 1 кг топлива, от 0 °С до заданной температуры — t.
Количество тепла, полученное продуктами сгорания, можно определить по формуле;
Q = УГср — t2) , [кДж/кг]
Где; Уг — полный объем продуктов сгорания 1 кг топлива [нм3/кг];
СР — средняя изобарная теплоемкость продуктов сгорания [кДж/нм3 -°С; 11 и 12 — высший и низший температурные уровни продуктов сгорания;
Приняв ^ = 0, и учитывая, что процессы горения и теплообмена являются изобарными, величину Q можно назвать энтальпией продуктов сгорания;
I 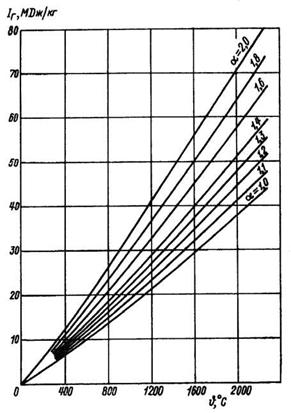
При тепловых расчетах котлов для определения энтальпии дымовых газов обычно пользуются тепловой
Диаграммой продуктов сгорания (I — t диаграммой), которая строится в зависимости от состава топлива и коэффициента избытка воздуха.
Эта диаграмма представляет собой семейство кривых, построенных по расчетам воздуха, необходимого для сгорания 1 кг топлива данного состава и определения объемов компонентов продуктов сгорания.
Топки паровых котлов. Организация топочного процесса. Топочные устройства. Организация дутья в паровых котлах
📽️ Видео
Основные стехиометрические законы химии. 10 класс.Скачать

Теория и практика сжигания топливаСкачать

Энергия топлива, удельная теплота сгорания топлива. Практическая часть - решение задачи. 8 класс.Скачать

Составление уравнений реакций горения. 11 класс.Скачать

Урок 114 (осн). Удельная теплота сгорания топлива. КПД нагревателяСкачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

М14 - Моделирование горения твёрдого топлива в ANSYS Fluent.Скачать

Горение топлива и выделение энергии 8 классСкачать

Стехиометрические расчеты. Практическая часть - решение задачи. 9 класс.Скачать

Физика 8 класс : Расчет количества теплоты сгорания топливаСкачать

Физика 8 класс (Урок№10 - Энергия топлива. Принципы работы тепловых двигателей.)Скачать

8 класс, 6 урок, Энергия топлива Удельная теплота сгоранияСкачать

1 неделя Общая характеристика топлива и расчет процесса горенияСкачать

Физика: горение и взрывСкачать

Моделирование процессов горения твёрдых частиц топлива в полостях различной конфигурацииСкачать

Тепловые явления. Тема 5. Горение. Удельная теплота сгорания топлива. Решение задач по теме ГорениеСкачать

Тепловые двигатели и их КПД. 8 класс.Скачать