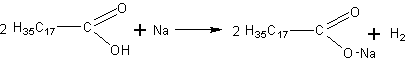При изучении высших кислот учащиеся подробно знакомятся со свойствами бытового химического продукта — мыла и впервые на практике встречаются с веществом, обладающим двойственной функцией, — олеиновой (непредельной) кислотой.
Свойства стеариновой кислоты. Стеариновая кислота в воде нерастворима, поэтому для опытов, иллюстрирующих ее кислотные свойства, нельзя, как обычно, воспользоваться водным раствором.
а) Расплавляют немного стеарина или стеариновой свечи в фарфоровой чашке и помещают в него небольшой кусочек натрия. Наблюдается выделение газа — водорода:
б) В пробирке растворяют кусочек стеарина в органическом растворителе (эфир, хлороформ, бензол) и к полученному раствору добавляют 2 капли спиртового раствора фенолфталеина. Затем вносят 1—2 капли разбавленного раствора гидроксида натрия и встряхивают пробирку. Розовой окраски раствора не наблюдается, так как стеариновая кислота нейтрализовала щелочь:
При дальнейшем прибавлении щелочи к раствору кислоты розовая окраска появляется после того, как кислота будет нейтрализована.
Добавляя щелочь к эфиру с фенолфталеином без стеариновой кислоты, наблюдают моментальное появление окраски.
в) В пробирку со спиртом добавляют 2—3 капли щелочи и 1-2 капли фенолфталеина и к полученной смеси при перемешивании прибавляют эфирный раствор стеариновой кислоты или даже твердый стеарин. При этом происходит обесцвечивание раствора вследствие нейтрализации щелочи.
Стеариновая кислота — кислота слабая. О силе стеариновой кислоты можно судить по гидролизу ее солей, например стеарата натрия C17H35COONa.
а) Растворяют в воде тонкие стружки простого мыла и добавляют спиртовой раствор фенолфталеина. Появление розовой окраски говорит о том, что стеариновая кислота — кислота слабая. Параллельно может быть испытан фенолфталеином водный раствор ацетата натрия. В этом случае розовая окраска если и появляется, то очень слабая, так как уксусная кислота сильнее стеариновой.
б) В цилиндр до половины наливают воду, а затем по стенке осторожно прибавляют небольшое количество спиртового раствора мыла с фенолфталеином. В спиртовом растворе гидролиз соли не происходит и розовая окраска не наблюдается. На границе же соприкосновения спиртового раствора соли с водой появляется розовое кольцо.
Получение мыла (стеарата натрия) из стеарина. Один из современных способов получения мыла состоит в нейтрализации кислот, получаемых окислением синтетических углеводородов или же непосредственным синтезом из водяного газа.
Кусочек стеарина (стеариновой кислоты) нагревают в химическом стаканчике с водой, пока стеарин не расплавится (темп. пл. 69°С), и приливают к нему понемногу раствор гидроксида натрия до полного растворения (стеарат натрия растворяется в воде). К полученному раствору прибавляют поваренную соль до насыщения.
В насыщенном растворе поваренной соли стеарат натрия не растворяется и всплывает наверх в виде хлопьев.
Получение стеариновой кислоты из мыла. Стеариновая кислота, как кислота слабая, может быть получена действием минеральной кислоты на мыло:
Как вещество не растворимое в воде, стеариновая кислота при этом выделяется из раствора.
В химическом стаканчике при нагревании готовят крепкий раствор мыла в воде. Для более быстрого растворения мыло должно быть предварительно нарезано в виде тонких стружек. Продолжая нагревать раствор мыла, прибавляют к нему раствор серной кислоты до выделения стеариновой кислоты. При охлаждении раствора 1 сверху образуется твердый слой стеариновой кислоты.
Таким способом в случае необходимости можно получить некоторое количество кислоты для классных занятий.
Моющее действие мыла. Мыло обладает свойством эмульгировать жиры и суспензировать твердые частички грязи.
а) Готовят, как было указано выше, раствор мыла в воде и прибавляют к нему 1 мл растительного масла. Смесь сильно взбалтывают до образования эмульсии, похожей на молоко. В другой пробирке подобным способом получают эмульсию из таких же количеств чистой воды и масла. Хотя во второй пробирке эмульсия была получена позднее, она быстро расслаивается на воду и масло. В первой же пробирке эмульсия оказывается устойчивой и не разделяется в течение всего урока.
б) В двух разных пробирках готовят суспензию сажи в воде и в мыльном растворе. Фильтруют растворы одновременно через бумажные фильтры. В первом случае фильтруется чистая вода, во втором случае мыльный раствор настолько сильно удерживает сажу, что суспензия, не разделяясь, проходит через фильтр.
Моющее действие мыла проявится еще более ярко, если фильтр с осадком сажи перевернуть на другую сторону, снова вложить в воронку и сперва пропустить через него воду, а затем мыльный раствор. Вода проходит прозрачной и не смывает сажу, мыльный же раствор совершенно очищает фильтр от сажи, становясь черным.
Действие жесткой воды на мыло. В жесткой воде мыло не дает пены и плохо мылит, так как превращается в нерастворимые в воде соли:
Хлопья нерастворимого мыла можно часто наблюдать при получении мыльного раствора в домашних условиях.
а) Раствор мыла в воде разливают в две пробирки. В одну из пробирок добавляют небольшое количество раствора хлорида кальция СаСI2. При встряхивании пробирок в одной из них наблюдают образование пены, в другой — отсутствие пены и образование осадка соли кальция.
б) В один цилиндр наливают около 50 мл дистиллированной воды, в другой такой же цилиндр — 50 мл водопроводной воды (если водопроводная вода очень «мягкая», в нее добавляют немного
раствора хлорида кальция). В оба цилиндра приливают по 1 мл спиртового раствора мыла и встряхивают. В первом случае образуется устойчивая пена. Во втором пены нет, но образуется осадок нерастворимой соли. Во второй цилиндр продолжают добавлять раствор мыла до тех пор, пока при встряхивании не будет получаться неисчезающая пена. По количеству затраченного раствора мыла можно приблизительно судить о степени жесткости воды.
Опыт показывает, что при пользовании жесткой водой большое количество мыла расходуется на осаждение кальциевых (и магниевых) солей и что только после их осаждения мыло, как поверхностно-активное вещество (ПАВ) начинает выполнять свою основную функцию — давать пену. Чтобы сделать воду «мягкой» и не расходовать мыло нерационально, соли кальция, как известно, осаждают предварительно кипячением или с помощью специальных добавок, например соды.
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Список тематических статей
Стеариновая кислота
Видео:Химические свойства кислот. 7 класс.Скачать

Общие сведения
Стеариновая кислота – неформальное название октадекановой кислоты, которая является, одноосновной насыщенной карбоновой кислотой, принадлежащей к гомологическому ряду одноосновных алифатических кислот. Общая формула октадекановой кислоты: CH3-(CH2)16-COOH. Используется и краткая формула: C17H35COOH. Стеариновая кислота впервые была получена во Франции из жира свиней в 1816 году.
Стеариновая кислота – одна из самых часто встречающихся твердых жирных кислот. Это химическое вещество, которое человек стал использовать одним из первых в своей истории, в частности, в качестве одного из моющих средств. Она представляет собой кристаллы, не имеющие цвета и нерастворимые в воде. Глицериды стеариновой кислоты – основной компонент разнообразных жиров и масел. Чистую стеариновую кислоту можно выделить из ее глицеридов при помощи гидролиза. На выходе, как правило, получают стеарин — результат реакции гидролиза жиров при изготовлении мыла. Он с химической точки зрения является смесью стеариновой и пальмитиновой кислот.
Рис.1. Внешний вид вещества
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Получение стеариновой кислоты
В мировой индустрии стеариновая кислота, в частности, получается методом дробного осаждения или дистилляцией из описанного выше стеарина. Кроме того, используется способ гидрирования олеиновой кислоты и прочие методы.
При этом самым употребляемым все-таки является метод производства путем выделения кислоты из стеариновой смеси. Существует возможность получения стеариновой кислоты также из жиров растительного происхождения, однако в подавляющем большинстве случаев ее производят из животных жиров.
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Свойства
1. Физические свойства
Молярная масса — 284,48 г/моль.
Плотность – 940 кг/куб.м.
Хорошая растворимость в диэтиловом эфире.
2. Термофизические свойства
Температура плавления — 69,6 градусов C.
Температура кипения — 376,1 градусов C.
3. Химические свойства
Важнейшим свойством является нейтрализация кислоты – она вступает в реакцию с основаниями с получением стеаратов металлов, например стеарата натрия:
C17H35COOH + NaOH = C17H35COONa + H2O
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Применение и природное значение
Один из основных секторов применения стеариновой кислоты – косметическая промышленность. В чистом виде кислота является компонентом разнообразной косметики и прочих продуктов по уходу за кожей, а полученная из нее соль — стеарат натрия является основой любого мыла. По сути мыла – это щелочные соли стеариновой кислоты. Также рассматриваемую кислоту используют при изготовлении свечей и в качестве умягчителя при производстве резин, резиновых смесей и изделий из них. Кроме того, стеараты различных металлов применяются в смазочной промышленности в составе различных марок пластичных смазок.
Химически чистая стеариновая кислота используется в органическом синтезе, в качестве реактива для аналитических реакций, например определения лития, кальция и магния. Техническую кислоту используют для диспергации компонентов и активации вулканизации в резиновой индустрии.
По своему биологическому значению стеариновая кислота является важнейшим соединением, часто встречающимся в природе. Она — одна из самых распространенных в окружающей среде жирных кислот. Рассматриваемая кислота является важным компонентом липидов (как глицерид стеариновой кислоты, чаще всего триглицерид животных жиров). Количество рассматриваемой кислоты в различных животных жирах варьируется, вплоть до 30 процентов в бараньем жире. При этом в жирах растительного происхождения самое большое содержание стеариновой кислоты наблюдается в пальмовом масле – до 10 процентов.
Стеариновая кислота обычно получается в живых организмах из присутствующей в них пальмитиновой кислоты. В качестве катализаторов реакции выступают ферменты, например элонгаз, который отвечает в организме за рост молекулярной цепи жирных кислот.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔥 ВидеоСерная кислота и ее соли. 9 класс.Скачать  Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать  Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать  СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать  Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Азотная кислота. Физические и химические свойства. 9 класс.Скачать  10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать  Свойства кислот и их применение. 8 класс.Скачать  47. Химические свойства кислотСкачать  Оксиды. Химические свойства. 8 класс.Скачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Серная кислота. Химические свойства. Реакции с металлами.Скачать  |