Видео:Амфотерные соединения. Классификация оксидов и гидроксидов.Скачать
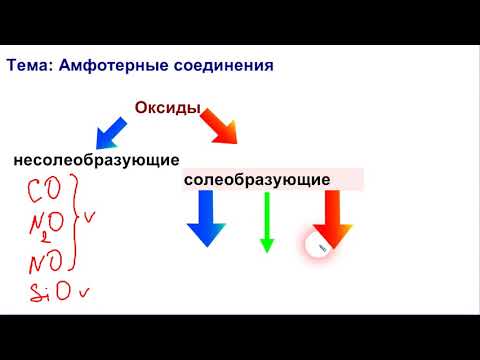
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Видео:Химические свойства амфотерных оксидов. Амфотерность.Скачать

Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ), |
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ),
C6O6 (диангидрид этилентетракарбоновой кислоты)
C12O12 (гексагидроксибензол трисоксалат),
и др.
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал),
N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота),
NO2 (диоксид азота, оксид азота (IV), двуокись азота),
N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид),
N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид),
и др.
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём)
P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора),
P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора)
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид),
SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты)
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора),
ClOClO3 ( перхлорат хлора ),
Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила),
Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид),
и др.
Ti2O3 (оксид титана(III), трёхокись титана),
TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила)
V2O3 (оксид ванадия (III), трехокись ванадия),
VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия),
V2O5 (оксид ванадия (V), пентаоксид диванадия)
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит),
CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома),
CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид)
Mn3O4 (оксид марганца (II,III), окисел марганца),
Mn5O8 (оксид марганца (II,IV), окисел марганца),
Mn2O3 (оксид марганца (III), окисел марганца),
MnO2 (оксид марганца (IV), диоксид марганца),
MnO3 (оксид марганца (VI), окисел марганца),
Mn2O7 (оксид марганца (VII))
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит),
Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк),
и др.
Co3O4 (оксид кобальта (II,III), окись кобальта),
Co2O3 (оксид кобальта (III), окись кобальта),
CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта)
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля)
CuO (оксид меди (II), окись меди),
Cu2O3 (оксид меди (III), триоксид димеди)
Ga2O3 (оксид галлия (III))
GeO2 (оксид германия (IV), диоксид германия, двуокись германия)
As2O5 (оксид мышьяка (V), пентоксид мышьяка)
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид)
Видео:АМФОТЕРНОСТЬ. Химические свойства амфотерных веществ - металлов, оксидов, гидроксидовСкачать

Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония ) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия), |
Nb2O3 (оксид ниобия (III), окись ниобия),
NbO2 (оксид ниобия (IV), окись ниобия),
Nb2O5 (оксид ниобия (V), окись ниобия)
MoO2 (оксид молибдена (IV), окись молибдена),
Mo2O5 (оксид молибдена (V), окись молибдена),
MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит)
Tc2O7 (оксид технеция (VII), окись технеция (VII))
RuO2 (оксид рутения(IV), окись рутения (IV)),
RuO4 (оксид рутения(VIII), тетраоксид рутения)
Rh2O3 (оксид родия (III), сесквиоксид родия),
RhO2 (оксид родия (IV), окисел родия)
PdO2 (оксид палладия (IV), окисел палладия)
Ag +1 Ag + 3 O 2 или Ag 2 O 2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра)
CdO (оксид кадмия (II))
InO (оксид индия (II), окись индия (II)),
In2O3 (оксид индия (III))
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит),
Sn3O4
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид),
Sb2O4 или Sb III Sb V O4 (тетраоксид сурьмы, диоксид сурьмы)
TeO3 (оксид теллура (V I ), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты),
Te4O9
I +2 O (монооксид йода),
I +4 O2 (диоксид йода),
I +3, +5 2O4 или I +3 O(I +5 O3) или (I +3, +5 O2)2 (тетраоксид дийода, иодноватокислый йод),
I +5 2O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид),
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

§ 43. Амфотерные оксиды и гидроксиды
Основные тезисы параграфа:
Оксиды и гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют амфотерными (от греч. «амфотерос» – оба, тот и другой).
Примеры химических реакций амфотерных оксидов:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
или
ZnO + 2NaOH (сплавление) Na2ZnO2 + H2O
Примеры химических реакций амфотерных гидроксидов:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Видео:ОКСИДЫ основные кислотные амфотерные как отличить | Оксиды химия 8 классСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Видео:Амфотерные оксиды и их свойства.Скачать

Амфотерные соединения
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами .
📹 Видео
Химия 8 класс: Амфотерные оксидыСкачать

4. КАК АМФОТЕРНЫЕ СОЕДИНЕНИЯ (ОКСИДЫ/ГИДРОКСИДЫ) РЕАГИРУЮТ С ЩЕЛОЧАМИ/ Нужно знать/ ЕГЭ химия 2020Скачать

8 класс рудзитис параграф 37 вычисления с использованием понятий количество веществаСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

29. Количество вещества. Задачи (часть 3)Скачать

Решение задач на ОЛЕУМ (H2SO4+SO3).Скачать

Как найти относительную молекулярную массу? Mr, Ar вещества | Скорая помощь по Химии | Урок 1Скачать

ащ-ащ!Скачать

№945. Найдите сторону АС и диагональ ОС трапеции ОВСА с основаниями ОА=а и BC=d, если точкаСкачать

128. Объёмная доля. Решение задач.Скачать

Алгоритм решения расчетных задач в аналитической химии.Скачать

8 класс Рудзитис параграф 36 решение задач количество вещества моль молярная массаСкачать


