Сравните реакции присоединения алкенов и диеновых углеводородов. Ответ подтвердите уравнениями химических реакций.
Видео:Реакции присоединения в алкенах | Химия 10 класс | УмскулСкачать

Реакции галогенирования
В результате реакций галогенирования алкенов и диеновых углеводородов образуются соответствующие галогеналканы, отличие состоит в том, что алкадиены реагируют с галогенами ступенчато, с промежуточным образованием галогеналкенов.
Видео:4.3. Алкадиены (диены): Химические свойства. ЕГЭ по химииСкачать

Реакции гидрирования
Протекают аналогично реакциям галогенирования, с образованием соответствующих алканов, отличие состоит в том, что в результате гидрирования алкадиенов сначала образуют алкен, который также способен присоединять водород.
Видео:Уравнивание реакций горения углеводородовСкачать

Реакции гидрогалогенирования
Реакции гидрогалогенирования алкенов и алкадиенов протекают согласно правилу Марковникова.
Гидрогалогенирование бутадиена-1,3:
CH2=CH–CH=CH2 + 2HBr ⟶ CH3–CHBr–CHBr–CH3
Видео:Химические свойства алкадиенов. 10 класс.Скачать

Сравните реакции присоединения алкенов и диеновых углеводородов ответ подтвердите уравнением реакции
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие углеводороды называют алкадиенами? Углеводороды, в молекулах которых содержатся две двойные углерод-углеродные связи и общая формула которых CnH2n-2, называют алкадиенами.
Напишите формулы одного гомолога и одного изомера пентадиена-1,3 с сопряжёнными двойными связями.
Гомолог пентадиена-1,3:
CH2=CH2―CH=CH―CH2―CH3 гексадиен-1,3
Изомер пентадиена-1,3:
CH3 ― CH=C=CH ― CH3 пентадиен-2,3
Задание 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH3 ― CH3 → CH3 ― CH2Br → CH3 ― CH2 ― OH → CH2=CH ― CH ― CH2
CH3 ― CH3 + Br2 ⟶ CH3 ― CH2Br + HBr
CH3 ― CH2Br + NaOH ⟶ CH3 ― CH2 ― OH + NaBr
2CH3 ― CH2 ― OH t,Al₂O₃,ZnO ⟶ H2C=CH ― CH=CH2 + 2H2O + H 2
б) CH3 ― CH(CH3) ― CH2 ― CH3 → CH2=C(CH3) ― CH=CH2 → изопреновый каучук
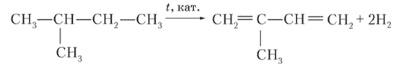 |
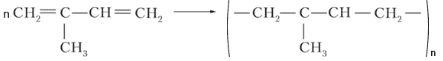 |
Задание 3
Сравните реакции присоединения алкенов и диеновых углеводородов. Ответ подтвердите уравнениями химических реакций на примере бутена-1 и бутадиена-1,3.
Реакции галогенирования.
Общее: образуются соответствующие галогеналканы.
Отличие: алкадиены реагируют с галогенами ступенчато, с промежуточным образованием галогеналкенов.
CH2=CH ― CH2 ― CH3 + Br2 ⟶ CH2Br ― CHBr ― CH2 ― CH3
Реакции гидрирования.
Общее: образуются соответствующие а лканы.
Отличие: алкадиены реагируют с водородом ступенчато, с промежуточным образованием алкенов.
CH2=CH ― CH2 ― CH3 + H2 t, кат. ⟶ CH3 ― CH2 ― CH2 ― CH3
Реакции гидрогалогенирования.
Общее: образуются соответствующие алканы, протекают согласно правилу Марковникова.
CH2=CH ― CH2 ― CH3 + HBr ⟶ CH3 ― CHBr ― CH2 ― CH3
CH2=CH ― CH=CH2 + 2HBr ⟶ CH3 ― CHBr ― CHBr ― CH3
Задание 4
Как можно доказать непредельный характер 2-метилбутадиена-1,З? Качественная реакция на непредельные соединения, в частности на 2-метилбутадиен-1,З – обесцвечивание бромной воды:
Напишите уравнения реакций, подтверждающих ступенчатое протекание реакции.
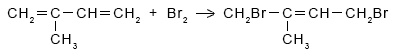 |
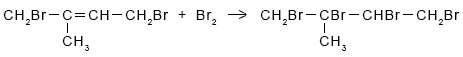 |
Задание 5
Найдите массу 2-метилбутадиена-1,З, который можно получить дегидрированием 72 кг 2-метилбутана, если выход продукта реакции составляет 80%.
Дано: m(C5H12)=72 кг, η(C5H8)=80%
Найти: mпракт.(C5H8)-?
Решение
1-й способ
1. Количество вещества 2-метилбутана рассчитываем по формуле: ʋ=m/M, где M ― молярная масса.
M( C5H12 )=72 кг/кмоль
ʋ(C5H12)=m( C5H12 )/M( C5H12 )=72 кг : 72 кг/кмоль=1 кмоль
2. Составляем химическое уравнение: C5H12 ⟶ C5H8 + 2H2
По уравнению реакции ʋ(C5H12): ʋ(C5H8)=1:1 , количества вещества одинаковые, поэтому :
ʋ(C5H8)=ʋ( C5H12 )=1 кмоль
3. Вычисляем теоретическую массу 2-метилбутадиена-1,3 количеством вещества 1 кмоль по формуле: m = ʋ •M
M( C5H8 )=68 кг/кмоль
mтеор.( C5H8 )= ʋ( C5H8 ) •M( C5H8) =1 кмоль • 68 кг/кмоль=68 кг
4. Рассчитываем массу 2-метилбутадиена-1,3, полученную практически:
mпракт.( C5H8 )= η(C5H8) •mтеор.( C5H8):100% =80% • 68 кг : 100%=54,4 кг
2-й способ
1. Составляем химическое уравнение:
72 кг х кг
C5H12 ⟶ C5H8 + 2H2
72 кг 68 кг
Над формулами соединений C5H12 и C5H8 записываем приведенную в условии задачи массу 2-метилбутана (72 кг) и неизвестную массу 2-метилбутадиена-1,3 (х кг), а под формулами соединений ― массы количества вещества согласно коэффициентам в химическом уравнении.
M( C5H12 )=72 кг/кмоль, поэтому масса 1 кмоль=72 кг
M( C5H8 )=68 кг/кмоль, поэтому масса 1 кмоль=68 кг
Теоретическую массу 2-метилбутадиена-1,3 рассчитываем с помощью пропорции:
72 кг / 72 кг = х кг / 68 кг, отсюда
х= mтеор.( C5H8)= 72 кг • 68 кг : 72 кг=68 кг
2. Рассчитываем массу 2-метилбутадиена-1,3, полученную практически:
mпракт.( C5H8 )= η(C5H8) •mтеор.( C5H8):100% =80% • 68 кг : 100%=54,4 кг
Ответ: mпракт.(C5H8)=54,4 кг
Задание 6
Англичанин Чарлз Макинтош предложил пропитывать плащевую ткань раствором натурального каучука, поэтому плащи, сшитые из такого материала, не промокали под сильным дождём; их назвали макинтошами. Однако они не были лишены недостатков, присущих натуральному каучуку: размягчались на солнце и становились хрупкими в мороз. В чём заключалось открытие американца Чарлза Гудьира, позволившее устранить эти недостатки плащевого материала? В 1839 году американский изобретатель Чарлз Гудьир открыл процесс вулканизации, который заключался в «сшивании» молекул каучука в единую пространственную трехмерную сетку с помощью серы, благодаря чему каучук становился сильнее и эластичнее, уменьшилась его растворимость.
Видео:Углеводороды: алкены. Химические свойства и получение | Химия ЕГЭ, ЦТСкачать

Лекция 7. Алкены. Диены. Алкины
Лекция 7 . Алкены. диены. алкины
Углеводороды состава СnН2n с открытой цепью, содержащие одну двойную связь, называются алкенами. Простейшим углеводородом этого ряда является этилен СН2=СН2. Атом углерода в этилене находится в sp2-гибридном состоянии (тригональный углерод). За счет трех гибридизованных орбиталей каждый атом углерода образует три s -связи: одну — с соседним атомом углерода, две — с двумя атомами водорода. Боковое перекрывания двух 2р-орбиталей атомов углерода дает p -связь и делает невозможным вращение вокруг s -связи углерод-углерод. Этим обусловлено явление геометрической изомерии.
Геометрические изомеры имеют одинаковый состав и способ связывания атомов, но расположение групп и атомов в пространстве различно. Для названия этих изомеров используется Е, Z-номенклатура. При этом возможно использование классических цис- и транс—обозначений для определения пространственного расположения одинаковых или сходных групп относительно плоскости сравнения.
Одинаковые по старшинству группы расположены по разные стороны от плоскости двойной связи. В этом соединении два метильных радикала находятся в цис-положении.
Одинаковые по старшинству группы расположены по одну сторону от плоскости двойной связи. В этом соединении два метильных радикала находятся в транс-положении.
Относительное старшинство заместителей при каждом атоме углерода с двойной связью определяется по атомному номеру: Н (атомный номер — 1) — младший, С (атомный номер — 6) — старший заместитель; если атомы при углероде с двойной связью одинаковы, то рассматривается старшинство последующих атомов: — СН3 (последующие атомы — Н, Н, Н) — младший заместитель; — СН(СН3)2 (последующие атомы — Н, С, С) — старший заместитель.
1.1 Химические свойства алкенов
1.1.1 Реакции электрофильного присоединения.
Функциональной группой в алкенах является двойная связь С=С. Характерная реакция двойной углерод-углеродной связи — электрофильное присоединение (электрофил — любящий электроны). При этом происходит разрыв менее прочной p —связи и образование вместо нее двух более прочных s -связей.
Реакция электрофильного присоединения протекает в две стадии:
I стадия — медленная, присоединение электрофила Е Å с образованием карбокатиона.
II стадия — быстрая, присоединение нуклеофила Nu (нуклеофил — любящий ядро).
По такому механизму протекает реакция присоединения галогеноводородов НСl, НВr, НI. Порядок увеличения реакционной способности галогеноводородов по отношению к алкенам совпадает с порядком увеличения их кислотности: НСl
Для присоединения воды к алкенам необходим катализатор — сильная минеральная кислота, которая дает протон Н Å — электрофил, а нуклеофилом является вода (Н2О) за счет неподеленной пары электронов на атоме кислорода. Подобным образом с алкенами реагирует спирт (RОH), который также имеет неподеленную электронную пару на атоме кислорода. В реакции с серной кислотой быстрая стадия — взаимодействие с нуклеофилом — ОSO2OH.
Присоединению хлора и брома, молекулы которых неполярны, предшествует поляризация
Под влиянием электронного облака двойной углерод-углеродной связи изменяется распределение электронной плотности в молекуле галогена. В первой медленной стадии присоединяется электрофил Br +, во второй — нуклеофил Br — .
Частицы, присоединяющиеся в медленной и быстрой стадиях электрофильного присоединения, приведены в таблице 1..
Реакции электрофильного присоединения
Электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона (правило Марковникова). Ряд устойчивости карбокатионов:
NB !! Чем устойчивее карбокатион, тем легче он образуется.
Алкильная группа проявляет электронодонорный индукционный эффект +I, подавая электроны s -связи на положительно заряженный атом углерода. При этом она приобретает некоторый положительный заряд, а заряд на центральном атоме в некоторой степени уменьшается. Чем больше распределен заряд в карбокатионе, тем он устойчивее.
Реакции электрофильного присоединения сопровождаются перегруппировками — образующийся в первой стадии карбокатион превращается в более устойчивый.
Аналогичным образом может происходить 1,2-сдвиг карбаниона CH3–, если в этом случае образуется более устойчивый карбокатион.
1.1.2 Свободно-радикальное присоединение
Свободно-радикальное присоединение бромоводорода НВ r ( NB !! но не HCl и HJ) в присутствии пероксидов как и электрофильное присоединение к алкенам происходит по общему правилу: реакция присоединения протекает через стадию образования более устойчивой промежуточной частицы. Различие только в том, что в первом случае на первой стадии присоединяется атом брома, во втором — Н Å .
Характер окисления алкенов зависит от используемого окислителя и условий реакции. Действие окислителя, который является электрофилом, всегда направлено в место повышенной электронной плотности — на атомы углерода, связанные двойной связью.
а) слабый окислитель
При действии холодного раствора перманганата калия (слабый окислитель) разрывается только p -связь и образуется две s -связи с кислородом.
б) мягкий окислитель
Действие другого мягкого окислителя — надкислоты — происходит также с сохранением углеродного скелета молекулы.
в) сильный окислитель
Под влиянием сильного окислителя ( КМnO4, Н Å ) разрывается не только p -, но и s -связь, разрушается углеродный скелет. В продуктах окисления все связи атомов углерода фрагмента >С=С
Действие озона и последующий гидролиз озонида водой (озонолиз) используется для установления структуры алкена:
1.1.4 Реакции присоединения
Алкены присоединяют водород в присутствии металлов VIII группы — платины, палладия, никеля.
Количество тепла, выделяющееся при гидрировании одного моля алкена, называется теплотой гидрирования и является мерой устойчивости алкена. Чем больше степень алкилирования углеродов при двойной связи, тем меньше теплота гидрирования и тем более устойчив алкен.
1.1.5 Полимеризация алкенов
а) Катионная полимеризация алкенов
Катионная полимеризация алкенов с одним или несколькими алкилами протекает как электрофильное присоединение под действием кислот (Н Å , AlСl3, BF3).
На каждой стадии присоединение молекулы изобутилена происходит упорядоченно, через образование наиболее устойчивого карбокатиона.
б) Анионная полимеризация алкенов
При анионном механизме полимеризации алкена, содержащего электроноакцепторную группу, инициатором является нуклеофил
в) Радикальная полимеризация алкенов
Этилен полимеризуется по радикальному механизму при высоких давлении и температуре.
1.2 Способы получения
1.2.1 Дегидратации спиртов
Алкены можно получить с помощью реакций дегидратации спиртов, которая протекают по правилу Зайцева: Н отщепляется от атома С, с которым связано наименьшее число атомов Н. Преобладающим продуктом реакции является наиболее устойчивый (наиболее алкилированный) алкен.
1.2.2 Дегидрогалогенирование (отщепление Н Cl , HBr ) галогеналканов
Эта реакция как и реакция дегидратации спиртов протекает по правилу Зайцева.
1.2.3 Дегидрогалогенированием вицинальных дигалогенидов (содержат атомы галогена у соседних атомов углерода)
1.2.4 Гидрирование алкинов
Гидрирование алкинов можно остановить на стадии образования алкенов, если уменьшить активность катализатора, добавив к нему соединения свинца.
Способы получения и характерные реакции алкенов изображены на схеме (рис. 1).
Рис.1. Способы получения и характерные реакции алкенов
Диены содержат две двойные углерод-углеродные связи. В зависимости от взаимного расположения двойных связей диеновые углеводороды можно разделить на три основных типа:
1) углеводороды с кумулированными (примыкающими к одному атому углерода) двойными связями – аллен и его гомологи;
2) углеводороды с сопряженными (конъюгированными) двойными связями – дивинил и его гомологи;
3) углеводороды с изолированными двойными связями. Наибольшего внимания заслуживают углеводороды с сопряженными двойными связями, в них двойные связи разделены одной простой.
Сопряженный диен более устойчив, чем воображаемый диен с двумя независимыми двойными связями. При гидрировании 1,3-бутадиена выделяется меньше энергии, чем удвоенная теплота гидрирования связи — НС = СН2. Выигрыш энергии называется энергией сопряжения. Устойчивость сопряженного диена может быть объяснена тем, что связь между двумя атомами углерода в sp2 — состоянии =С-С= более короткая, чем простая связь. Чем короче связь, тем больше ее энергия. В некоторой степени стабильность сопряженного диена связана с взаимодействием p -электронных облаков соседних p -связей.
2.1 Химические свойства диенов
2.1.1 Реакции электрофильного присоединения
Для сопряженных диенов характерны реакции электрофильного присоединения галогенов, галогеноводородов. Особенностью этих реакций является присоединение не только по каждой из двойных связей (1,2 — присоединение), но и по концам сопряженной системы (1,4 — присоединение).
Механизм реакции:
Первая стадия — присоединение протона — протекает с образованием более устойчивого карбокатиона.
В аллильном карбокатионе положительно заряженный углерод находится в a —положении по отношению к двойной связи. Такой катион так же устойчив, как третичный, вследствие распределения заряда: половина положительного заряда находиться на одном атоме углерода, а половина — на другом, два p -электрона распределены по р-орбиталям трех атомов углерода:
NB !Ни одна из граничных структур с локализованными зарядами (I и II), в которых различно только разделение p -электронов, не показывает правильно строение карбокатиона. Реальная частица представляет собой нечто промежуточное между ними — резонансный гибрид этих структур.
Вторая стадия — присоединение аниона брома к любому из положительно заряженных атомов углерода.
Относительные количества образующихся 1,2- и 1,4-продуктов присоединения зависят от температуры и продолжительности реакции.
При любой температуре 1,2-присоединение происходит быстрее из-за более низкого энергетического барьера превращения карбокатиона в 1,2-продукт. При обычной температуре имеющейся энергии достаточно, чтобы оба продукта “перевалив” через энергетический барьер, вновь образовали карбокатион (обратная реакция). Более устойчивый 1,4-продукт накапливается за счет 1,2-продукта, так как переход от 1,2- к 1,4-продукту сопровождается выигрышем энергии (- D Н1,4 > — D Н1,2).
2.1.2 Реакция Дильса-Альдера
Диеновым синтезом называется реакция сопряженных диенов с ненасыщенными соединениями (реакция Дильса-Альдера). Реакция происходит с большой легкостью при наличии электродонорных групп в диене и электроакцепторных групп в диенофиле.
Реакция Дильса-Альдера стереоспецифична : конфигурации диена и диенофила сохраняются в аддукте.
2.1.3 Полимеризация диенов
Полимеризация диена идет предпочтительно по 1,4-положениям.
Натуральный каучук представляет собой цис-полиизопрен.
Гуттаперча — транс-изомер полиизопрена.
Диены получают теми же способами, что и простые алкены: при крекинге углеводородов, дегидратацией двухатомных спиртов, дегидрогалогенированием дигалогенпроизводных.
Алкины имеют общую формулу СnH2n-2 и содержат тройную углерод-углеродную связь. Первый член гомологического ряда алкинов – (этин) ацетилен НС º СН. Атом углерода в ацетилене находится в sp-гибридном состоянии. За счет двух гибридных орбиталей каждый атом углерода образует две s -связи с другим углеродом и водородом. Ацетилен — линейная молекула.
В результате перекрывания двух негибридизированных р-орбиталей атомов углерода образуются две p -связи. Вследствие большего s-характера sp-орбитали (по сравнению с sp2- и sp3- орбиталями) связь º С-Н в ацетилене короче, чем связи =С-Н и — С-Н в алкенах и алканах. Из-за большей близости электронной пары связи º С-Н к углероду она обладает заметной полярностью, это облегчает гетеролитический разрыв связи с образованием ионов.
Водород, связанный с углеродом при тройной связи, проявляет значительную кислотность.
🎥 Видео
Химические свойства алкеновСкачать

Алкены. Ч.3-1. Химические свойства. Реакции присоединения + механизм электрофильного присоединения.Скачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Реакции изомеризации углеводородовСкачать

Механизм реакции ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ у АЛКЕНОВСкачать

Углеводороды. Тема 12. Физические и химические свойства алкеновСкачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Гидрируем и дегидрируем углеводородыСкачать

Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать

4.2. Алкадиены (диены): Способы получения. ЕГЭ по химииСкачать

Реакции нуклеофильног замещения. Галогенпроизводные углеводородовСкачать

"Реакция присоединения к сопряженным диенам I: механизм"Скачать

Все о реакциях присоединения в органике. Правило Марковникова | Химия ЕГЭ для 10 класса | УмскулСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать






































