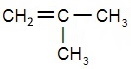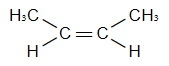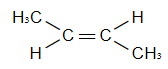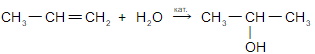- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Этан: способы получения и свойства
- Гомологический ряд этана
- Строение этана
- Изомерия этана
- Химические свойства этана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование этана
- 2. Дегидрирование этана
- 3. Окисление этана
- 3.1. Полное окисление – горение
- Получение этана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение этана в промышленности
- Сравните по химическим свойствам этан и этен запишите уравнения реакций
- Разница между этаном и этеном
- Видео:
- Содержание:
- Главное отличие — этан против этена
- Ключевые области покрыты
- Что такое этан
- Что такое этен
- Сходство этана и этена
- Разница между этаном и этеном
- Определение
- Химическая формула
- Гибридизация углерода
- Молярная масса
- Температура плавления
- Угол скрепления
- Длина связи C-C
- C-H Длина Связи
- Заключение
- Видео:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

We are checking your browser. gomolog.ru
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7076fbe5c8369781 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Этан: способы получения и свойства
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Видео:Алкены. Ч.3-3. Химические свойства. Реакции окисления и горения.Скачать

Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Решение цепочек превращений по химииСкачать

1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
| Например. При нитровании этана образуется преимущественно нитроэтан: Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  2. Дегидрирование этанаДегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  3. Окисление этанаЭтан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеЭтан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С. Видео:1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать  Получение этанаВидео:Все химические свойства алкенов в одном вебинаре | Химия ЕГЭ | УмскулСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
Задание 1
Задание 2
Задание 3 Задание 4 Задание 5 Видео:Физические и химические свойства алкенов | Химия 10 класс #12 | ИнфоурокСкачать  Разница между этаном и этеномВидео:Видео №3. Как составить изомерыСкачать  Видео:Содержание:Главное отличие — этан против этенаУглеводороды — это молекулы, состоящие из атомов углерода (C) и водорода (H). Большинство углеводородов содержится в сырой нефти. Этан и этен являются такими углеводородами, которые имеют простую молекулярную структуру, но очень полезны во многих отраслях промышленности. Этан является насыщенным углеводородом. У него нет двойных связей. Этен является ненасыщенным углеводородом. У него двойная связь. Однако оба являются алифатическими углеводородами, поскольку они не являются циклическими структурами. Основное различие между этаном и этеном что атомы углерода этана являются sp 3 гибридизуется, тогда как атомы углерода в этене являются sp 2 гибридизовал. Ключевые области покрыты1. Что такое этан Ключевые термины: алифатический, этан, этен, этилен, гибридизация, углеводороды, пи-бонды, сигма-бонды. Что такое этанЭтан является углеводородом, состоящим из двух атомов углерода и шести атомов водорода. Это насыщенный углеводород, который не имеет двойных связей в своей структуре. Два атома углерода связаны друг с другом через ковалентную связь. Атомы водорода связаны с атомами углерода через одинарные связи. Три атома водорода связаны с каждым углеродом. Атомы углерода этана являются sp 3 гибридизовал. Следовательно, не существует негибридизованных p-орбиталей для образования пи-связей. Следовательно, в этане присутствуют только сигма-связи. Рисунок 1: Молекулярная структура этана Молярная масса этана составляет около 30,07 г / моль. Это бесцветный газ без запаха при комнатной температуре и атмосферном давлении. Температура плавления этана составляет около -182,8 о C. Химическая формула этана дана как C2ЧАС6, Поскольку нет двойных связей, этан можно отнести к категории алканов. Этан является вторым по важности компонентом природного газа. Этан является легковоспламеняющимся; следовательно, он горючий. Это компонент природного газа. Этан также используется в качестве реагента для производства этилена. Поскольку этилен является важным компонентом в ряде отраслей промышленности, он очень важен в качестве реагента. Кроме того, этан является хладагентом, который используется в холодильных системах, которые вызывают охлаждение. Что такое этенЭтен является углеводородом, который состоит из двух атомов углерода и четырех атомов водорода. Химическая формула этена является C2ЧАС4, Два атома углерода связаны друг с другом через двойную связь. Следовательно, этен является ненасыщенным углеводородом. Два атома углерода являются sp 2 гибридизовал. Молекулярная геометрия этена плоская. Рисунок 2: Молекулярная структура этена Молярная масса этена составляет около 28,05 г / моль. Температура плавления этена составляет -169,2 о C. При комнатной температуре и атмосферном давлении этен представляет собой бесцветный газ с характерным запахом. Угол связи между связями этена составляет около 121,3 о , Поскольку атомы углерода состоят из негибридизованных p-орбиталей, эти орбитали могут образовывать пи-связь между двумя атомами углерода. Эта двойная связь вызывает реакционную способность этена. Общее название для этена этилен, Он используется в производстве полимерных материалов, таких как полиэтилен, путем полимеризации этенового мономера. Этилен также играет важную роль в растениях как гормон, который регулирует созревание плодов. Сходство этана и этена
Разница между этаном и этеномОпределениеЭтан: Этан является углеводородом, состоящим из двух атомов углерода и шести атомов водорода. Этилен: Этен является углеводородом, состоящим из двух атомов углерода и четырех атомов водорода. Химическая формулаЭтан: Химическая формула этана является C2ЧАС6. Этилен: Химическая формула этена является C2ЧАС4. Гибридизация углеродаЭтан: Атомы углерода этана являются sp 3 гибридизовал. Этилен: Атомы углерода этена sp 2 гибридизовал. Молярная массаЭтан: Молярная масса этана составляет около 30,07 г / моль. Этилен: Молярная масса этена составляет около 28,05 г / моль. Температура плавленияЭтан: Температура плавления этана составляет около -182,8 о C. Этилен: Температура плавления этена составляет около -169,2 о C. Угол скрепленияЭтан: Угол связи Н-С-С связи в этане составляет около 109,6 о . Этилен: Угол связи Н-С-С связи в этене составляет около 121,7 о . Длина связи C-CЭтан: Длина связи С-С в этане составляет около 154 мкм. Этилен: Длина связи С-С в этене составляет около 133 пм. C-H Длина СвязиЭтан: Длина связи C-H в этане составляет около 110 мкм. Этилен: Длина связи С-Н в этене составляет около 108 пм. ЗаключениеИ этан, и этен можно найти в качестве основных компонентов в природном газе. Это очень легковоспламеняющиеся и горючие. Хотя этен можно использовать в качестве мономера для производства полимеров, этан нельзя использовать для этой цели. Это связано с тем, что этан не имеет ни двойной связи, ни функциональной группы. Это главное различие между этаном и этаном. |








![Алканы: химические свойства. Практика. [4] Органика С НУЛЯ | Химия для 10 класса и ЕГЭ-2024](https://i.ytimg.com/vi/kTXlMZuTgIw/0.jpg)