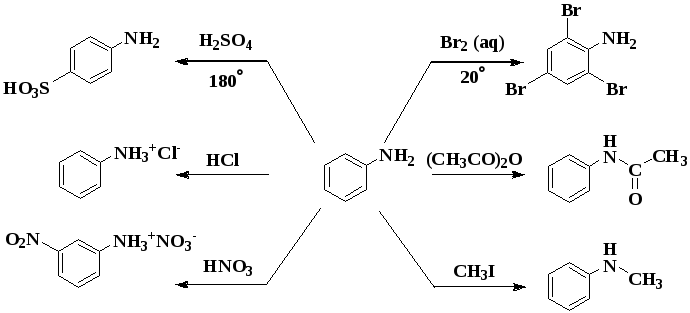
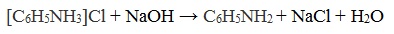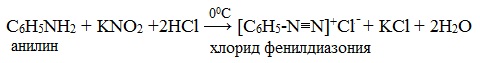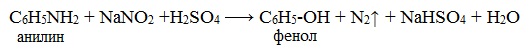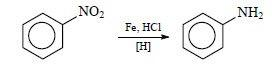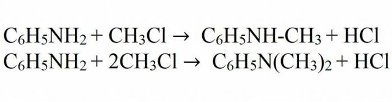Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
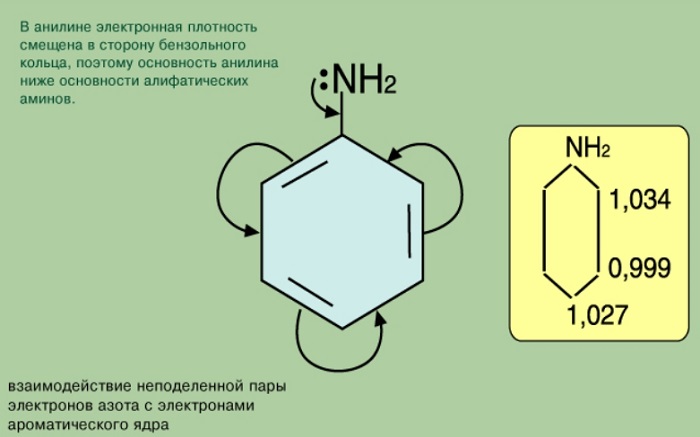
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
- I. Основные свойства
- II. Особые свойства анилина
- III. Окисление анилина
- IV. Диазотирование анилина
- Сравните химические свойства анилина и бензола ответ поясните уравнениями химических реакций
- Анилин. Свойства анилина.
- Строение анилина.
- Физические свойства анилина.
- Получение анилина.
- Химические свойства анилина.
- Применение анилина.
- Анилин — структурная формула и свойства органического соединения
- Анилин (фениламин) — понятие, строение, физические свойства
- Получение анилина
- Химические свойства анилина
- Применение анилина
- 🔍 Видео
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора.
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
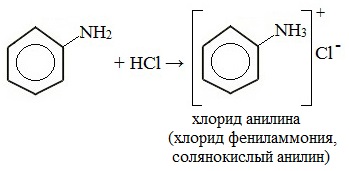
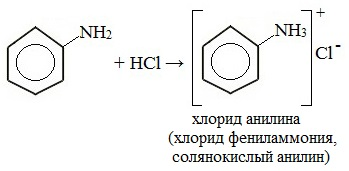
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
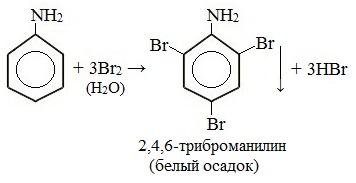
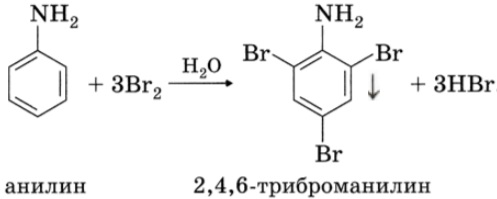
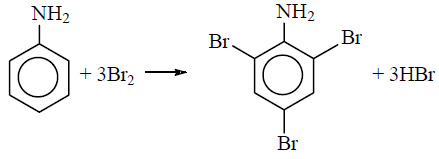
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
Качественная реакция на анилин!
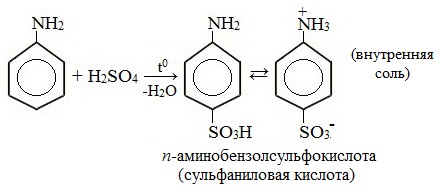
2. Сульфирование
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
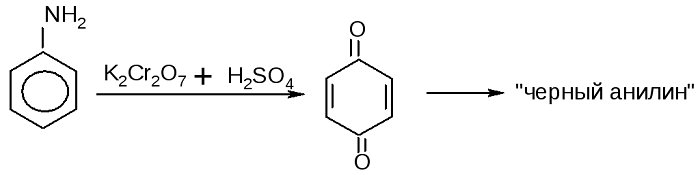
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Сравните химические свойства анилина и бензола ответ поясните уравнениями химических реакций
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие вещества называют аминами?
Аминами называют органические вещества, в молекулах которых углеводородный радикал связан с аминогруппой ―NH2.
Как классифицируют амины по природе углеводородного радикала?
На предельные и ароматические амины.
В предельных аминах углеводородный радикал ― остаток предельных углеводородов, а в ароматических ― остаток ароматических углеводородов.
Задание 2
Амины называют органическими основаниями. Почему?
Водные растворы аминов содержат в небольшой степени гидроксид-анионы ОН — и имеют щелочную среду. Благодаря этому и способности образовывать соли с неорганическими кислотами их называют органическими основаниями.
Напишите уравнения реакций подтверждающих эту характеристику.
CH3NH2 + H2O ⇄ [CH3NH3] + + OH-
CH3NH2 + HCl ⟶ [CH3NH3]Cl
Сравните основные свойства аммиака, метиламина и анилина.
Основные свойства метиламина выражены сильнее, чем в аммиака. В молекуле метиламина атом азота соединен с углеводородным радикалом, а поскольку электроотрицательность водорода меньше, чем углерода и азота, происходит смещение электронов от трех атомов водорода к атому углерода и затем к атому азота, в результате электронная плотность на атоме азота увеличивается, а повышение электронной плотности превращает азот в более сильного донора пары электронов, то есть способность присоединять к себе катион водорода по донорно-акцепторному механизму, что повышает основные свойства вещества. 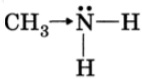
Основные свойства анилина выражены слабее, чем в аммиака. В молекуле анилина атом азота соединен с фенильным радикалом, происходит смещение электронов от атома азота к бензольному кольцу, вследствие этого электронная плотность на атоме азота уменьшается и аналин является более слабым основанием, чем аммиак. 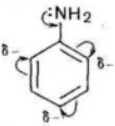
Таким образом, а ммиак является более сильным основанием, чем анилин, но более слабым, чем метиламин.
Задание 3
На примере молекулы анилина рассмотрите третье положение теории химического строения органических соединений о взаимном влиянии атомов в молекулах. Ответ подтвердите уравнениями химических реакций.
С одной стороны, в молекуле анилина происходит смещение электронной плотности от аминогруппы к бензольному кольцу, в результате уменьшается электронная плотность на атоме азота и ослабевают основные свойства анилина. Анилин в водном растворе не меняет окраску лакмуса и фенолфталеина.
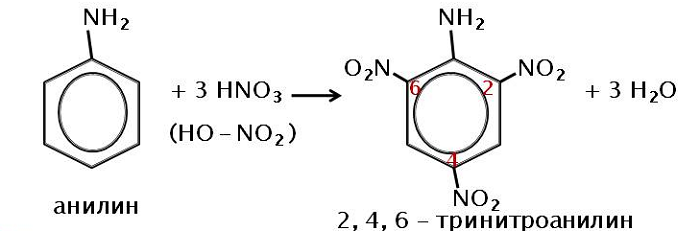
С другой стороны, увеличивается электронная плотность в бензольном кольце, сильнее всего ― в положениях 2, 4 и 6 относительно аминогруппы, поэтому реакции замещения анилина протекают легче. При действии на анилин брома реакция замещения протекает при обычных условиях без использования катализатора и замещается три атома водорода, образуя 2,4,6-триброманилин.
Задание 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорметан ⟶ метанол ⟶ метиламин ⟶ бромид метиламмония.
CH3Cl + NaOH ⟶ CH3OH + NaCl
CH3OH + NH3 ⟶ CH3NH2 + H2O
CH3NH2 + HBr ⟶ [CH3NH3]Br
Задание 5
Смешали 10 л газообразного метиламина (н.у.) и 10 г хлороводорода. Какая масса кристаллического хлорида метиламмония при этом образовалась? Какой газ и в каком объёме остался в колбе после окончания реакции?
Дано: V(CH3NH2)=10 л, m(HCl)=10 г
Найти: m([CH3NH3]Cl)-?, Vостаток(газа)-?
Решение
1. Вычисляем количество вещества метиламина в объёме 10 л по формуле: n=V/VM, где VM ― молярный объём.
n(CH3NH2)=V(CH3NH2)/VM=10 л : 22,4 л/моль=0,446 моль
2. Вычисляем ко личество вещества хлороводорода массой 10 г по формуле: n =m/M, где M ― молярная масса.
M (HCl )=36,5 г/моль
n(HCl)=m(HCl)/M(HCl)=10 г : 36,5 г/моль=0,274 моль
3. Составим химическое уравнение:
HCl + CH3NH2 =[CH3NH3]Cl
По уравнению реакции 1 моль HCl рагирует с 1 моль CH3NH2 , количество вещества одинаковое, то есть с 0,274 моль хлороводорода реагирует 0,274 моль метиламина. По условию задачи имеем 0,446 моль метиламина, следовательно он взят в избытке, то есть реагирует не полностью, поэтому расчеты будем проводить по данным хлороводорода.
n( [CH3NH3]Cl )= n прореаг.( CH3NH2 )= n( HCl )=0,274 моль
nостаток( CH3NH2 )=n ( CH3NH2 )-n прореаг.( CH3NH2 )=0,446 моль-0,274 моль=0,172 моль
4. Вычисляем массу хлорида метиламмония в количестве вещества 0,274 моль формуле: n=m/M, где M ― молярная масса.
M( [CH3NH3]Cl )=67,5 г/моль
m( [CH3NH3]Cl )=n ( [CH3NH3]Cl ) • M( [CH3NH3]Cl )=0,274 г • 67,5 г/моль=18,5 г
5. Вычисляем объём остатка метиламина в количестве вещества 0,172 моль по формуле: V= n • VM, где VM ― молярный объём .
n( CH3NH2 )=n( CH3NH2 ) • VM=0,172 моль • 22,4 л/моль=3,85 л
Ответ: образовалось 18,5 г хлорида метиламмония и осталось 3,85 л метиламина.
Задание 6
При сжигании органического вещества образовалось 1,26 г воды, 0,896 л оксида углерода (IV) и 0,224 л азота (н.у.). Найдите молекулярную формулу этого вещества.
Известно: органическое вещество СхHyNz, m(H2O)=1,26 г, V(СО2)=0,896 л, V(N2) =0,224 л
Найти: формулу СхHyNz — ?
Решение
1-й способ
1. Вычисляем ко личество вещества воды массой 1,26 г по формуле: n =m/M, где M ― молярная масса.
M (H2O )=18 г/моль
n(H2O)=m( H2O )/M( H2O )=1,26 г : 18 г/моль=0,07 моль
2. Вычисляем количество вещества CO2 и N2 в заданном объёме по формуле: n=V/VM, где VM ― молярный объём .
n( CO2 )=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль
n(N 2 )=V( N 2 )/VM=0,224 л : 22,4 л/моль=0,01 моль
3. Вычисляем количество вещества атомов С в 0,04 моль СО2.
n(C)=n(CO2)=0,04 моль
4. Вычисляем количество вещества атомов H в 0,07 моль H2O. В 1 моль Н2О содержится 2 моль атомов Н, а в 0,07 моль Н2О количества вещества атомов в 2 раза больше:
n(H)=2•n(H2O)=2•0,07 моль=0,14 моль
5. Вычисляем количество вещества атомов N в 0,01 моль N2. В 1 моль N2 содержится 2 моль атомов N, а в 0,01 моль N2 количества вещества атомов в 2 раза больше:
n(N)=2•n(N2)=2•0,01 моль=0,02 моль
6. Находим соотношение атомов в веществе:
х:у:z=n(C) : n(H) : n(N)=0,04:0,14:0,02
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,02) равно единице, а большее число делим на него, тогда
х:у:z=0,04/0,02 : 0,14/0,02 : 0,02/0,02=2:7:1, следовательно, формула имеет вид C2H7N, или C2H5-NH 2
2-й способ
1. Вычисляем количество вещества CO2 в объёме 0,896 л и N2 в объёме 0,224 л по формуле: n=V/VM, где VM=22,4 л/моль при н.у.
n( CO2 )=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль
n(N 2 )=V( N 2 )/VM=0,224 л : 22,4 л/моль=0,01 моль
2. Составляем пропорцию для вычисления массы атомов C в 0,04 моль СО2 и решаем ее:
В 1 моль СО2 содержится 12 г С, а
в 0,04 моль СО2 ― х г С
х=m(C)=0,04 моль • 12 г : 1 моль = 0,48 г
3. Составляем пропорцию для вычисления массы атомов N в 0,01 моль N2 и решаем ее:
В 1 моль N2 содержится 28 г N, а
в 0,01 моль H2O ― х г N
х=m(N)=0,01 моль • 28 г : 1 моль = 0,28 г
4. Составляем пропорцию для вычисления массы атомов H в 1,26 г Н2О и решаем ее:
В 18 г H2O содержится 2 г H, а
в 1,26 г H2O ― х г H
х=m(H)=1,26 г • 2 г : 18 г = 0,14 г
5. Находим соотношение атомов в веществе:
х:у:z=m(C)/M(C) : m(H)/M(H) : m(N)/M(N)=0,48/12 : 0,14/1 : 0,28/14=0,04:0,14:0,02
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,02) равно единице, а большее число делим на него, тогда
х:у:z=0,04/0,02 : 0,14/0,02 : 0,02/0,02=2:7:1, следовательно, формула имеет вид C2H7N, или C2H5―NH 2
Ответ: C2H7N, или C2H5―NH 2
Задание 7 Создайте компьютерные 3D-модели молекул метиламина и анилина. Рассмотрите взаимное расположение атомов и атомных групп относительно атома азота. Сделайте самостоятельно.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Анилин. Свойства анилина.
Анилин (фениламин) C5H5NH2 – представитель класса ароматических аминов, в которых аминогруппа связана напрямую с бензольным кольцом.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Строение анилина.
Неподеленная пара атома азота реагирует с π-системой бензольного кольца. Взаимодействие можно представить так:
На атоме азота появляется частично положительный заряд, и основные свойства понижаются. А в бензольном кольце, наоборот, электронная плототность повышается, и наиболее сильно в орто- и пара- положениях:
Видео:Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Физические свойства анилина.
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворимы в воде, но хорошо – в этиловом спирте и в бензоле.
Видео:Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Получение анилина.
1. Основным способом получения анилина является процесс восстановления нитробензола. Для этого используют никелевый или медный катализатор при 250-350 °С:
В лаборатории используют восстановления цинка в кислой среде или алюминия в щелочной:
Видео:9.3. Фенол: Химические свойстваСкачать

Химические свойства анилина.
Анилин является более слабым основанием, чем алифатические амины, т.к. электронная пара азота частично смещена в бензольное кольцо.
Анилин вступает в реакцию с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
2. Анилин вступает в реакции электрофильного замещения в безольном кольце. Аминогруппа направляет замещение в орто- и пара- положения. Анилин легко бромируется, при этом выпадает белый осадок:
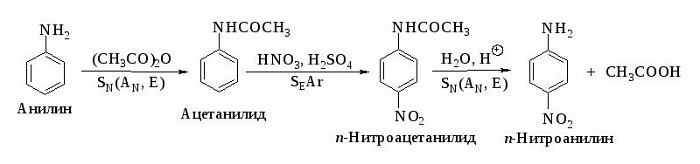
3. С концентрированной азотной кислотой анилин взаимодействует со взрывом. На время реакции можно защитить аминогруппу (превратить ее в амидную перед нитрованием), а после нитрования гидролизовать амид с образованием исходной аминогруппы:
3. При взаимодействии с азотистой кислотой образуются соли диазония:
4. Анилин легко подвергается окислению, темнее при хранении. Если на анилин действовать хлорной известью, то водный раствор анилин окрашивается в интенсивный фиолетовый цвет. Это реакция является качественной.
Видео:Химические свойства фенола. 10 класс.Скачать

Применение анилина.
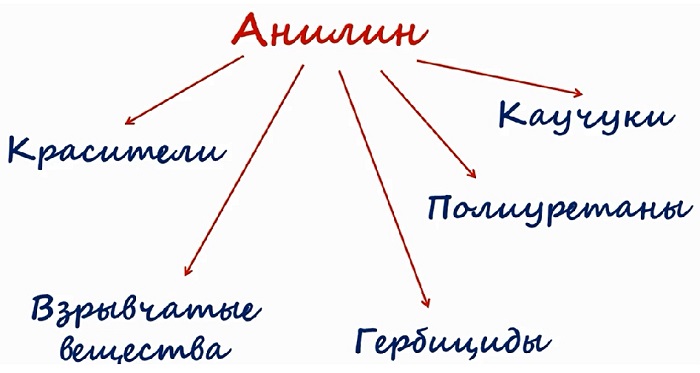
Анилин используют преимущественно для синтеза лекарственных средств и красителей:
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Анилин — структурная формула и свойства органического соединения
Анилин – это соединение, которое относят к органическим веществам. Принадлежит к классу аминов. Чтобы понять, что такое амины, можно представить формулу аммиака, затем один атом водорода или все заменить углеводородным радикалом.
Видео:Химические свойства бензола | Химия 10 класс | УмскулСкачать

Анилин (фениламин) — понятие, строение, физические свойства
Если в формуле аммиака только один водородный атом заменить фенил радикалом, получится анилин (фениламин). Поэтому его можно считать производным аммиака. Вещество называют также аминобензол.
Можно иначе представить это соединение. Если в формуле бензола вместо одного водорода поставить аминогруппу, получается анилин. Значит это производная бензола, где атом водорода замещается на аминогруппу.
Эмпирическая (молекулярная) формула фениламина C6H5 NH2. Его записывают с помощью структурной формулы:
Аминобензол содержит две группы атомов: аминогруппу и фенил радикал. Они оказывают влияние на свойства вещества.
Аминогруппа NH2– состоит из атома азота и двух атомов водорода. У азота на внешнем энергетическом уровне содержится 5 электронов. Два электрона образуют химическую связь с атомами углерода, один электрон образует связь с углеродом фенил радикала. У него еще остаётся два электрона. Они образуют свободную пару электронов.
Аминогруппа в составе анилина может присоединять протон водорода. Поэтому соединение проявляет свойства оснований. Так как по определению, вещества, присоединяющие протон водорода, принято считать основаниями.
Фенил радикал C6H5 – имеет в своём составе бензольное кольцо. Благодаря этому фениламин должен вступать в реакции, характерные для бензола.
Так как 2 группы атомов находятся в одном соединении, они оказывают влияние друг на друга.
Фенил радикал, влияя на функциональную группу, вовлекает свободную пару электронов в π — электронную систему. Такое смещение плотности влияет на проявление свойств соединения как основания. В результате фениламин не вступает во взаимодействие с водой. Аммиак, таким образом, более сильное основание.
Функциональная группа влияет на π — систему. Нарушается равномерное распределение электронной плотности. Она повышается у атомов 2,4,6 (в орто — и пара — положениях). Именно здесь будет идти замена водорода на другие атомы в химических реакциях.
Фениламин — это жидкость, маслянистая и ограниченно растворяющаяся в воде. Растворяется в органических соединениях.
Кипит при температуре 184 0 С, замерзает при температуре –6 0 С. При окислении окрашивается в красно-бурый цвет. Молярная масса 93 г/моль. Плотность вещества при 20 0 С составляет 1,02173 г/см 3 .
Вещество ядовито. Его относят ко второму классу опасности. При контакте с кожей может вызвать аллергию. При попадании в организм вызывает отравление. Есть информация о том, что оно может вызвать генетические мутации, возникает риск возникновения раковых заболеваний. Его называют ядом крови, так как вызывает кислородное голодание.
Видео:Разбор ЕГКР по химии, вариант 2 | ЕГЭ-2024Скачать

Получение анилина
Фениламин получают из нитробензола. Данный способ был предложен русским учёным Н. Н. Зининым. Поэтому получил название «реакция Зинина».
Проводят взаимодействие железа с нитробензолом в присутствии соляной кислоты.
Идёт восстановление нитробензола до анилина. Синтез можно представить уравнениями реакций:
Fe + 2HCl = FeCl2 + 2H
При взаимодействии анилина с галогеналканами и спиртами получают смесь вторичных, а также третичных аминов. Такое превращение носит название алкилирование.
Видео:Фенолы. Химические свойства. 1 часть. 10 класс.Скачать

Химические свойства анилина
Для вещества характерны две группы свойств.
Реакции, идущие за счет функциональной группы.
Фениламин взаимодействует с кислотами. В результате образуются соли. При взаимодействии анилина с хлороводородной кислотой получается хлорид фениламмония, или анилин солянокислый:
Свойства, идущие за счёт фенил радикала.
Для фениламина характерна реакция замещения, например бромирование. В результате получают 2,4,6 триброманилин. Образуется осадок белого цвета, поэтому реакцию считают качественной на обнаружение данного вещества.
Уравнение реакции с бромом выглядит следующим образом:
Нитрование, при котором происходит замещение в кольце ароматических аминов:
Вступает во взаимодействие с азотной кислотой, образуя тринитроанилин.
Видео:10 класс § 37 "Химические свойства бензола и его гомологов".Скачать

Применение анилина
Большая часть фениламина идёт для синтеза красителей. Его используют в получении типографской краски и синтетических красителей для текстильной промышленности.
Так в кислой среде анилин окисляется дихроматом калия, в результате получается чёрный краситель. Эта реакция также рассматривается как качественная на фениламин:
Вещество является исходным для получения лекарственных препаратов. Сульфаниламидные соединения, получаемые на основе анилина, используют в медицине в качестве лекарств. Это производные анилина. К ним относятся: парацетамол, фенацетин и другие.
Также на основе соединения производят химические средства защиты растений, различные смолы, крем для обуви, взрывчатые вещества.
🔍 Видео
Химические свойства феноловСкачать

ФЕНОЛ и АНИЛИН: чем похожи и чем отличаются? | Химия ЕГЭ 2022 | УмскулСкачать

6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

Бензол и его гомологи | Химические свойства | ПолучениеСкачать

ФенолыСкачать

9.1. Фенол: Строение, номенклатураСкачать