Металлический литий получают двумя способами: электролизом и вакуумтермией. Вследствие высокой химической активности лития и термодинамической устойчивости его соединений процессы его получения связаны с рядом трудностей. Они заключаются в ограниченности выбора возможных способов получения, в необходимости защиты получающегося металла от действия кислорода, азота, углекислого газа и водяных паров, в подборе конструкционных материалов, устойчивых к действию лития и его соединений при повышенной температуре.
Электрохимическое получение лития. Электрохимические характеристики показывают, что литий можно получить только электролизом расплавов, электролиз водных растворов невозможен. В водных растворах электродный потенциал лития имеет очень большое отрицательное значение, вследствие чего на катоде при электролизе будет выделяться водород. Для электролиза обычно используют расплавы галогенидов, однако индивидуальные галогениды лития LiCl и LiF для этой цели непригодны вследствие высоких температур плавления, при которых давление паров лития становится довольно большим. Для снижения температуры плавления электролита используют смесь LiCl и КС1 в соотношении 1:1; такой состав близок к составу эвтектики в системе LiCl– КС1 [58,5 % (мол.) LiCl, Тпл = 361°С ]. Электролиз проводят при 400–430°С.
Напряжение разложения хлоридов магния, кальция и натрия в расплавах меньше напряжения разложения хлорида лития при 700°С, В:
2,60 3,38 3,39 3,41 3,53
Эти элементы будут восстанавливаться на катоде раньше лития и поэтому будут полностью переходить в металл. Напряжение разложения хлорида калия лишь очень немного больше напряжения разложения хлорида лития. Такая небольшая разница сохраняется в широком интервале температур. В результате выделение калия на катоде увеличивается при обеднении расплава электролита хлоридом лития, поэтому состав электролита постоянно нужно корректировать, добавляя LiCl и не допуская снижения его концентрации ниже 55–57%. Для уменьшения загрязнения металлического лития магнием, кальцием и натрием необходимо использовать исходный хлорид лития высокой степени чистоты.
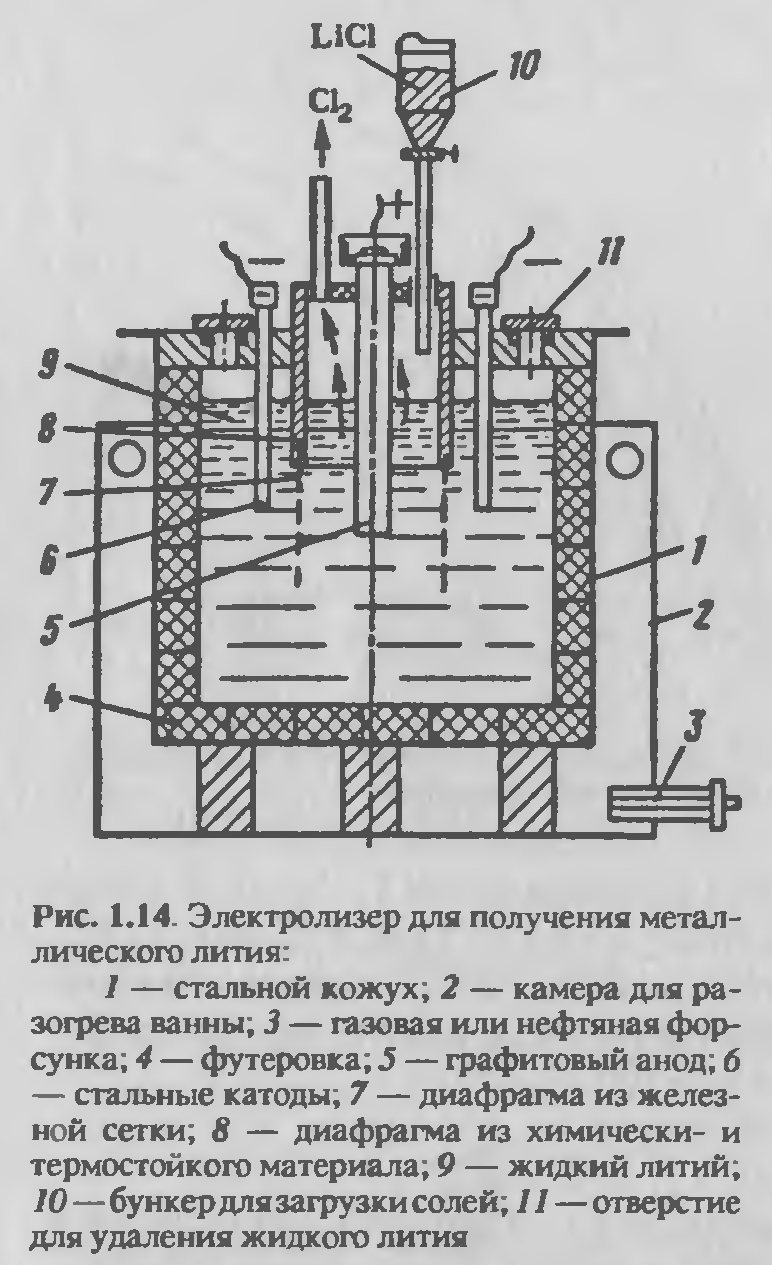
Для электролиза используют электролизеры с разделенными анодным и катодным пространствами (рисунок 2.13). Корпус электролизера стальной, футерован графитом, материалом, наиболее устойчивым по отношению к расплавленному хлориду лития. Футеровка из графита служит около трех месяцев, так как постепенно разрушается вследствие образования карбида лития. Более чистый металл получают в электролизерах со стальными водоохлаждаемыми стенками, на которых образуется гарнисаж из затвердевших солей электролита. Аноды графитовые, катоды — из малоуглеродистой стали, но могут использоваться и более стойкие металлы, такие как ниобий и тантал. Катодное и анодное пространство разделяют диафрагмой из железной сетки. При электролизе литий, вследствие меньшей плотности, чем расплав солей, собирается на поверхности расплава электролита в катодном пространстве. Расплавленный литий защищен от соприкосновения с воздухом тонкой пленкой расплавленных солей. По мере накопления расплавленного лития он удаляется вручную. Хлор из анодного пространства отсасывается вентиляторами и направляется на нейтрализацию известковым молоком.
Электролиз характеризуется следующими показателями: выход по току 90–93 %, расход электроэнергии на 1 кг лития до 144 кВт·ч. И извлечение лития до 95 %, напряжение на ванне 6–6,6В. Содержание примесей в электролитическом литии, %: 0,3–2,5 Na; 0,02–1,50 К; 0,002–0,12 А1; 0,003 Mg; 0,001–0,04 Са, Fe, Сu; 0,004–0,8 Si; 0,01 С1.
Электрохимический метод может быть использован для получения сплавов лития с другими металлами — магнием, алюминием, кальцием, свинцом и др. При получении сплавов с легкоплавкими металлами с невысокой плотностью возможны два варианта проведения процесса электролиза. По первому — хлорид соответствующего металла вводится в состав электролита; по второму — из этого металла изготовляется катод, который по мере выделения лития растворяется в нем. В обоих случаях образуется жидкий сплав, собирающийся на поверхности расплава электролита.
Электрохимический метод является достаточно эффективным и применяется в промышленных масштабах. В то же время он не лишен недостатков, важнейшие из которых следующие: необходимый для него безводный хлорид лития высокой чистоты является дорогим продуктом; получающийся металлический литий загрязнен примесями, прежде всего натрием, что требует дополнительной его очистки; выделяющийся при электролизе хлор необходимо обезвреживать.
Рисунок 2.13 — Электролизер для получения металлического лития.
Вакуумтермическое восстановление. Термодинамический анализ реакций типа приведенной ниже показывает, что большинство из них характеризуется положительными значениями изменения энергии Гиббса особенно велики они для восстановления фторидов и хлоридов:
LiX + M → Li + MX, где Х — F, С1, О.
Это является следствием того, что соединения лития с кислородом и особенно с фтором и хлором термодинамически более прочны, чем соответствующие соединения наиболее активных металлов-восстановителей (Na, Са, Mg, А1 и др.). При таких термодинамических характеристиках осуществление металлотермического процесса становится возможным при условии удаления получаемого металла из зоны реакции или связывания получаемых продуктов каким-либо компонентом, дополнительно вводимым в исходную шихту. В результате равновесие реакции смещается вправо, этому благоприятствует относительно низкая температура кипения лития.
Наиболее подходящими для восстановления оксида лития оказались элементарный кремний и металлический алюминий, имеющие высокие температуры кипения.
При восстановлении лития кремнием в шихту вводят оксид кальция, который связывает образующийся оксид кремния и препятствует образованию силиката лития. Суммарная реакция процесса может быть выражена уравнением:
Оксид лития, необходимый для процесса, получают термическим разложением карбоната лития. Для этого нагревают в вакууме при 850°С брикетированную смесь Li2CO3 и СаО, взятых в соотношении 1:1,5. Оксид кальция добавляют для предотвращения плавления карбоната и облегчения удаления углерода. Полученную смесь оксидов измельчают, шихтуют с кремнием, который берется с избытком 10 %, нагревают в вакуумной печи при давлении 0,1 Па и температуре 1000–1300°С. Извлечение лития при 1000°С составляет 75 %, а при 1300 °С увеличивается до 93 %. Основные примеси в металлическом литии: 0,01 % Si и 0,04 % Са.
При восстановлении оксида лития алюминием в шихту также добавляют оксид кальция, который связывает образующийся оксид алюминия и препятствует образованию алюмината лития:
Лучшие результаты по получению лития повышенной чистоты дает восстановление алюмината лития, которое не требует введения в шихту СаО.
Исходный алюминат получают путем взаимодействия стехиометрических количеств карбоната лития и оксида алюминия в вакууме при 900–1000°С. Процесс восстановления проводят при давлении 10 Па и температуре 1150–1200 °С. Извлечение лития достигает 95–98 %.
Металлотермическое восстановление оксида лития имеет некоторые преимущества перед электролизом расплавов: в качестве исходного сырья используется карбонат лития, являющийся основным продуктом большинства современных технологических схем переработки литиевого сырья. Способ позволяет получать из технических продуктов более чистый литий, чем электрохимический метод; восстановителями служат кремний и алюминий, относительно дешевые и доступные.
Дата добавления: 2015-06-22 ; просмотров: 3824 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- Литий: способы получения и химические свойства
- Качественная реакция
- Химические свойства
- Литий
- История и происхождение названия
- Получение
- Физические свойства
- Химические свойства
- Изотопы лития
- Геохимия лития
- Применение
- Термоэлектрические материалы
- Химические источники тока
- Ракетное топливо
- Лазерные материалы
- Окислители
- Дефектоскопия
- Пиротехника
- Сплавы
- Электроника
- Металлургия
- Металлургия алюминия
- Легирование алюминия
- Ядерная энергетика
- Литий-6 (термояд)
- Литий-7 (теплоноситель)
- Сушка газов
- Медицина
- Смазочные материалы
- Регенерация кислорода в автономных аппаратах
- Силикатная промышленность
- Прочие области применения
- Дополнительные данные
- Периодическая система химических элементов Менделеева
- 💡 Видео
Видео:Получение гидроксида лития | Preparation of lithium hydroxideСкачать

Литий: способы получения и химические свойства
Литий — это щелочной металл, серебристо-белого цвета. Самый легкий из металлов, мягкий, низкая температура плавления.
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Качественная реакция
Качественная реакция на литий — окрашивание пламени солями лития в карминно-красный цвет .
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства
Литий — активный металл; на воздухе реагирует с кислородом и азотом, и покрывается оксидно-нитридной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Литий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами .
1.1. Литий легко реагирует с галогенами с образованием галогенидов:
2Li + I2 = 2LiI
1.2. Литий реагирует с серой с образованием сульфида лития:
2Li + S = Li2S
1.3. Литий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид лития и гидрид лития:
3Li + P = Li3P
2Li + H2 = 2LiH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
1.5. Литий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом литий образует оксид.
2. Литий активно взаимодействует со сложными веществами:
2.1. Литий бурно реагирует с водой . Взаимодействие лития с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2Li 0 + H2 + O = 2 Li + OH + H2 0
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Литий взаимодействует с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , литий бурно реагирует с соляной кислотой :
2Li + 2HCl = 2LiCl + H2↑
2.3. При взаимодействии лития с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии лития с концентрированной серной кислотой образуется сульфат лития, диоксид серы и вода:
2.4. Литий реагирует с азотной кислотой:
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ +2H2O
2.5. Литий может реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
2.6. В расплаве литий может взаимодействовать с некоторыми солями . Обратите внимание! В растворе литий будет взаимодействовать с водой, а не с солями других металлов.
Например , литий взаимодействует в расплаве с хлоридом алюминия :
3Li + AlCl3 → 3LiCl + Al
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Литий
 Мягкий металл серебристо-белого цвета
Мягкий металл серебристо-белого цвета(молярная масса)
(первый электрон)
(по Полингу)
| Li | 3 |
| 6,941 | |
| [He]2s 1 | |
| Литий | |
Ли́тий — химический элемент главной подгруппы первой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 3. Обозначается символом Li ( Lithium ). Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Хамфри Дэви в 1825 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» ( λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Видео:Получение гидроксида литияСкачать

Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Видео:Уравнивание реакций горения углеводородовСкачать

Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), которая при холодной обработке переходит в кубическую плотноупакованную решётку, где каждый атом, имеющий двойную кубооктаэдрическую координацию, окружён 12 другими. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380° С и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химические свойства
Щелочной металл, неустойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует.
Во влажном воздухе медленно окисляется, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °С до 300 °С литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °С. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с аммиаком и с галогенами (с иодом — только при нагревании).
Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на кожу, слизистые оболочки и в глаза.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6 Li (7,5 %) и 7 Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь ввиду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов и два ядерных изомера ( 4 Li − 12 Li и 10m1 Li − 10m2 Li соответственно). Наиболее устойчивый из них, 8 Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3 Li (трипротон), по-видимому, не существует как связанная система.
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть вскоре после Большого Взрыва). Образование элемента лития в звездах возможно по ядерной реакции «скалывания» более тяжелых элементов.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т.
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Применение
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Химические источники тока
Литий используют в анодах химических источников тока (аккумуляторов, например литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидрооксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Ракетное топливо
| Окислитель | Удельная тяга (Р1, сек) | Температура сгорания °С | Плотность топлива г/см 3 | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 378,3 сек | 5350 °C | 0,999 | 4642 м/сек | 28 % |
| Тетрафторгидразин | 348,9 сек | 5021 °C | 0,920 | 4082 м/сек | 21,07 % |
| ClF3 | 320,1 сек | 4792 °C | 1,163 | 4275 м/сек | 24 % |
| ClF5 | 334 сек | 4946 °C | 1,128 | 4388 м/сек | 24,2 % |
| Перхлорилфторид | 262,9 сек | 3594 °C | 0,895 | 3028 м/сек | 41 % |
| Окись фтора | 339,8 сек | 4595 °C | 1,097 | 4396 м/сек | 21 % |
| Кислород | 247,1 сек | 3029 °C | 0,688 | 2422 м/сек | 58 % |
| Перекись водорода | 270,5 сек | 2995 °C | 0,966 | 3257 м/сек | 28,98 % |
| N2O4 | 239,7 сек | 3006 °C | 0,795 | 2602 м/сек | 48 % |
| Азотная кислота | 240,2 сек | 3298 °C | 0,853 | 2688 м/сек | 42 % |
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Лития сульфат используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия).
Легирование алюминия
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления емкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний
Литий-6 (термояд)
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 1H (Т):
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6 LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7 (теплоноситель)
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких как уран, торий или плутоний.
Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов, жидкий литий-7 (часто в виде сплава с натрием или цезием-133) служит эффективным теплоносителем. Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Соли лития обладают психотропным действием и используются в медицине при профилактике и лечении ряда психических заболеваний. Наиболее распространен в этом качестве карбонат лития. применяется в психиатрии для стабилизации настроения людей, страдающих биполярным расстройством и частыми перепадами настроения. Он эффективен в предотвращении мании депрессии и уменьшает риск суицида.Медики не раз наблюдали, что некоторые соединения лития (в соответствующих дозах, разумеется) оказывают положительное влияние на больных, страдающих маниакальной депрессией. Объясняют этот эффект двояко. С одной стороны, установлено, что литий способен регулировать активность некоторых ферментов, участвующих в переносе из межклеточной жидкости в клетки мозга ионов натрия и калия. С другой стороны, замечено, что ионы лития непосредственно воздействуют на ионный баланс клетки. А от баланса натрия и калия зависит в значительной мере состояние больного: избыток натрия в клетках характерен для депрессивных пациентов, недостаток – для страдающих маниями. Выравнивая натрий калиевый баланс, соли лития оказывают положительное влияние и на тех, и на других.
Смазочные материалы
Стеарат лития — литиевое мыло используется в качестве высокотемпературной смазки.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 и супероксид LiO2 применяются для очистки воздуха от углекислого газа; при этом последние два соединения реагируют с выделением кислорода (например, 4LiO2 + 2CO2 → 2Li2CO3 + 3O2), благодаря чему они используются в изолирующих противогазах, в патронах для очистки воздуха на подлодках , на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление различной косметики).
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Дополнительные данные
Литий, Lithium, Li (3)
Когда Дави производил свои знаменитые опыты по электролизу щелочных земель, о существовании лития никто и не подозревал. Литиевая щелочная земля была открыта лишь в 1817 г. талантливым химиком-аналитиком, одним из учеников Берцелиуса Арфведсоном. В 1800 г. бразильский минералог де Андрада е Сильва, совершая научное путешествие по Европе, нашел в Швеции два новых минерала, названных им петалитом и сподуменом, причем первый из них через несколько лет был вновь открыт на острове Уте. Арфведсон заинтересовался петалитом, произвел полный его анализ и обнаружил необъяснимую вначале потерю около 4% вещества. Повторяя анализы более тщательно, он установил, что в петалите содержится «огнепостоянная щелочь до сих пор неизвестной природы». Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь в отличие от кали и натра впервые была найдена в «царстве минералов» (камней); название зто произведено от греч.- камень.
Позднее Арфведсон обнаружил литиевую землю,или литину, и в некоторых других минералах, однако его попытки выделить свободный металл не увенчались успехом. Очень небольшое количество металлического лития было получено Дэви и Бранде путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития. В русской химической литературе начала XIX в. встречаются названия: литион, литин (Двигубский, 1826) и литий (Гесс); литиевую землю (щелочь) называли иногда литина.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
💡 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролиз. 10 класс.Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Получение спиртов с помощью LiAlH4Скачать

Решение цепочек превращений по химииСкачать

Литий. Как добывается, где применяется и когда закончитсяСкачать