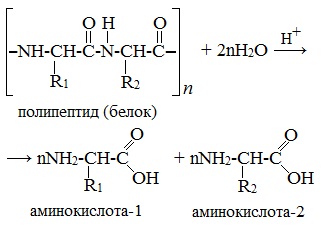
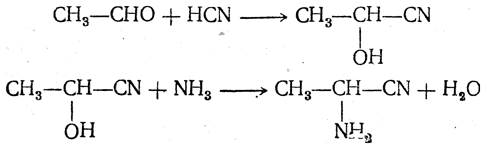
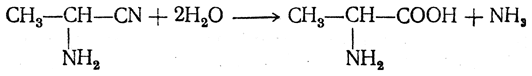
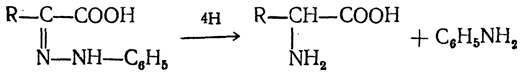
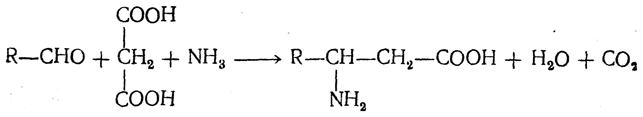
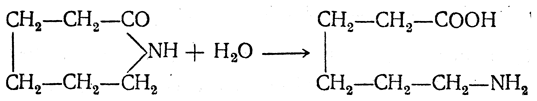
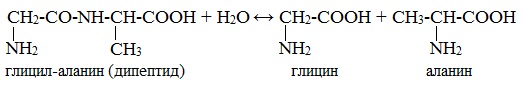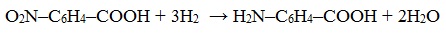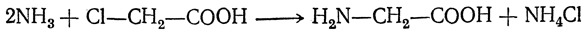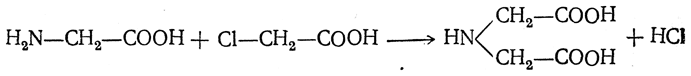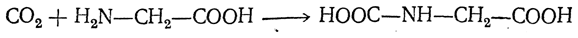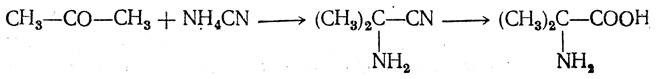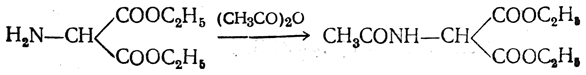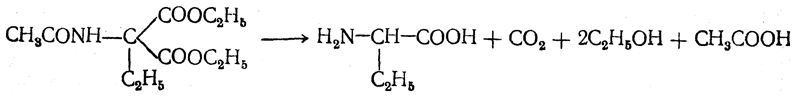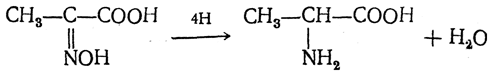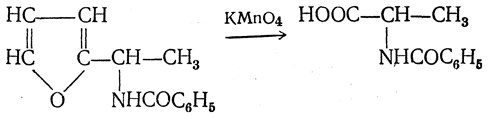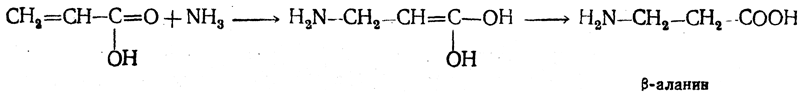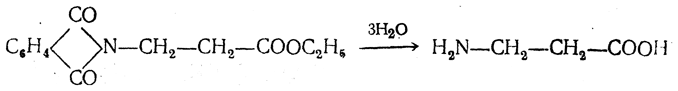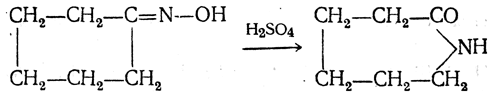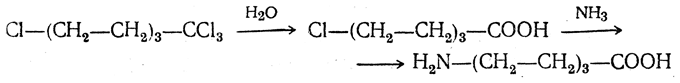Большинство аминокислот можно получить в результате химических реакций или при гидролизе белков.
- 1. Из карбоновых кислот через их галогенопроизводные в радикале
- 2. Гидролиз пептидов и белков
- 3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
- 4. Микробиологический синтез
- Общие способы получения аминокислот
- Аминокислоты получение и химические свойства
- Источники:
- 📹 Видео
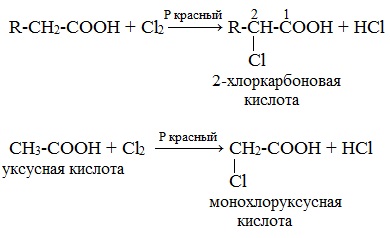
1. Из карбоновых кислот через их галогенопроизводные в радикале
Галогенирование карбоновых кислот
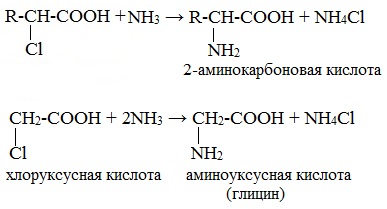
Взаимодействие α-галогенкарбоновых кислот с избытком аммиака (аммонолиз)
На второй стадии происходит замещение атома галогена в галогенкарбоновых кислотах на аминогруппу. Выделяющийся при этом хлороводород связывается избытком аммиака в хлорид аммония:
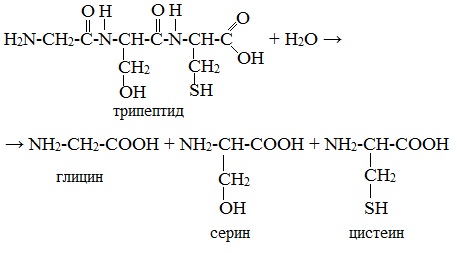
2. Гидролиз пептидов и белков
α-Аминокислоты образуются при гидролизе пептидов и белков.
При гидролизе белков обычно образуются сложные смеси α-аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
4. Микробиологический синтез
Этот способ основан на способности специальных микроорганизмов вырабатывать в питательной среде в процессе жизнедеятельности определенную α-аминокислоту.
Видео:12.2. Амины: Способы получения. ЕГЭ по химииСкачать

Общие способы получения аминокислот
Чтобы свести к минимуму нежелательное образование иминодиуксусной кислоты по реакции
реакцию ведут с очень большим избытком аммиака или в присутствии карбоната аммония, который защищает аминогруппу. Образующееся карбаминовое производное аминокислоты
легко разлагается при нагревании.
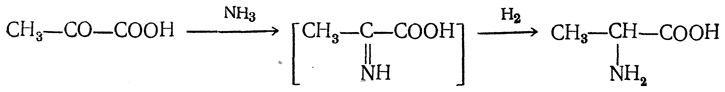
2. Получение из циангидринов альдегидов и кетонов (циангидринный метод). Важной реакцией получения α-аминокислот является действие аммиака на циангидрины альдегидов и кетонов
Аминонитрилы можно получить также, действуя на альдегиды или кетоны непосредственно цианистым аммонием. Эта реакция приобрела особое значение после того, как Н. Д. Зелинский с сотрудниками показали, что синильную кислоту и аммиак или цианистый аммоний можно заменить смесью водных растворов хлористого аммония и цианистого калия, в результате обменного разложения дающих цианистый аммоний, который и вступает в реакцию с альдегидами или кетонами:
3. Синтезы из сложных эфиров, содержащих подвижный атом водорода. Большое значение приобрели синтезы аминокислот из малонового, циануксусного и ацетоуксусного эфиров. Пользуясь этими методами, можно получить аминокислоты, содержащие различные радикалы.
а) Синтез из малонового эфира. Из малонового эфира получают нитрозомалоновый эфир, который восстанавливают в аминомалоновый эфир водородом в присутствии катализатора или цинком в кислой среде:
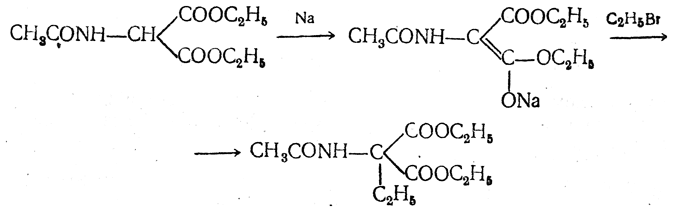
полученный ацетиламиномалоновый эфир алкилируют, действуя на него последовательно металлическим натрием и галоидным алкилом:
После омыления и декарбоксилирования получается α-аминокислота:
б) Синтез из циануксусного эфира проводится аналогично синтезу из малонового эфира.
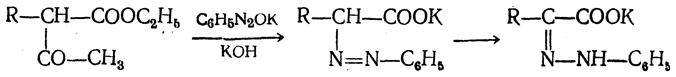
в) Синтез из ацетоуксусного эфира. При действии на однозамещенные ацетоуксусные эфиры раствором фенилдиазотата, а затем щелочью отщепляется уксусная кислота и образуется неустойчивое азосоединение, которое изомеризуется в фенилгидразон соответствующей кетокислоты:
Восстановление фенилгидразона кетокислоты цинком в солянокислой спиртовой среде приводит к α-аминокислоте:
Этот метод синтеза аминокислот предложен В. В. Феофилактовым.
4. В осст а н ов л ен и е оксимов или гидразонов альдегид о- или кетонокислот. Например:
Особенно удачным оказался метод, состоящий в одновременном действии на кетокислоту аммиака и водорода в присутствии катализатора (платины или палладия). По-видимому, при этом промежуточно образуется иминопроизводное:
Этим методом синтезируют аминокислоты, содержащие изотоп азота N 15 («меченый азот»), которыми пользуются при изучении поведения аминокислот в живом организме.
В последние годы предложено еще два новых общих метода синтеза аминокислот, основанных на использовании дешевого промышленного сырья — фурана и тиофена.
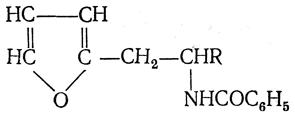
5. Синтез аминокислот из фурановых производных (метод А. П. Терентьева и Р. А. Грачевой) основан на легкости окисления фуранового кольца перманганатом с образованием карбоксильной группы. Если в боковой цепи у фуранового кольца имеется аминогруппа (обычно защищенная бензоильной группой), то в результате окисления получается бензоиламинокислота, а после омыления — сама аминокислота. В зависимости от положения аминогруппы в цепи получается α-, β-, γ- и т. п. кислота.
Так, при окислении 1-бензоиламино-1-(α-фурил)-алкилов получается α-кислота, например из 1-бензоиламино-1-(α-фурил)-этана — бензоил-α-аланин:
Для получения β-аминокислот пользуются 2-бензоиламино-1-(α-фурил)алкилами
а для синтеза γ-аминокислот берут 3-бензоиламино-1-(α-фурил)-алкилы:
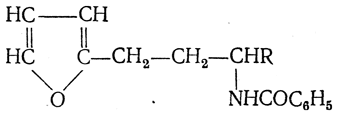
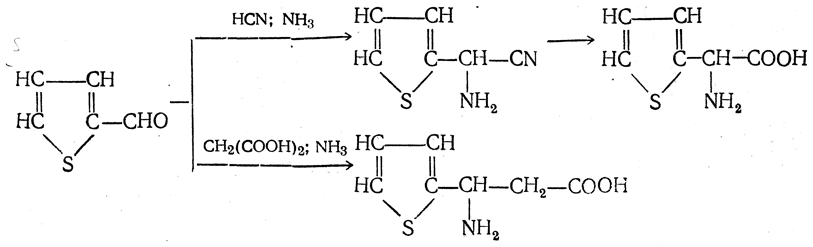
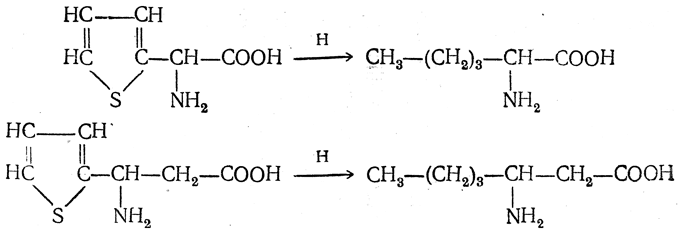
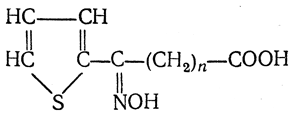
6. Синтез аминокислот из производных тиофен а (метод Я. Л. Гольдфарба, Б. П. Фабричного и И. Ф. Шалавиной) основан на восстановительном десульфировании производных тиофена или его гомологов водородом скелетного никелевого катализатора. В зависимости от взятого производного десульфирование приводит к аминокислотам с разным положением аминогруппы.
Из тиенилальдегида обычными методами получают тиенил-α- или тиенил-β -аминокислоты
которые затем десульфируют:
Из разных оксиминокислот тиофенового ряда
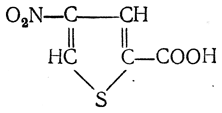
можно получать аминокислоты с любым положением аминогруппы. Наконец, можно ввести непосредственно в ядро тиофена нитро- и карбоксильную группы, например
и затем прогидрировать полученное соединение никелем Ренея. Этим путем можно получать только γ- и δ-аминокислоты.
Способы получения аминокислот с удаленной аминогруппой (β-, γ-, δ-, ε-, . . ., ω-аминокислот). Кроме общих способов получения аминокислот, дающих возможность синтезировать как
α-аминокислоты, так и кислоты с удаленной аминогруппой, для получения последних имеются и специальные методы, рассматриваемые ниже.
1. Присоединение аммиака к ненасыщенным кислотам. При действии аммиака в спиртовом растворе на α,β-ненасыщенные кислоты или их эфиры аминогруппа вступает в β-положение. Как и в случае присоединения воды при образовании оксикислот, аммиак, вероятно, сначала присоединяется в положение 1,4 системы сопряженных двойных связей:
Поэтому присоединение аммиака идет против правила Марковникова.
Реакцию удобнее проводить, действуя на эфир акриловой кислоты не аммиаком, а фталимидом (в присутствии гидроокиси триметилфениламмония как катализатора):
Гидролизом образующегося эфира фталил-β-аланина можно получить и сам β-аланин:
2. Конденсация альдегидов с малоновой кислотой в присутствии спиртового раствора аммиака. Этот путь синтеза, разработанный В. М. Родионовым с сотрудниками, является общим методом получения β-аминокислот:
3. Получение из оксимов циклических кетон о в. δ- и ε-Аминокислоты получают чаще всего из оксимов циклических кетонов путем так называемой бекмановской перегруппировки. Так, например, оксим циклогексанона под действием серной кислоты изомеризуется с расширением цикла, в результате чего образуется ε-капролактам:
Эта реакция используется для производства капролактама в промышленном масштабе. Гидролиз капролактама приводит к ε-аминокапроновой кислоте:
4. Получение «-аминокислот действием аммиака на ω-га л о и дз а м еще н н ы е кислоты. ω-Аминокислоты с нечетным числом углеродных атомов получаются из тетрахлоралканов типа Сl—(СН2—СН2)n—ССl3, являющихся продуктами реакции теломеризации. Гидролиз тетрахлоралканов указанного типа, полученных из этилена и четыреххлористого углерода, приводит к ω-хлоркарбоновым кислотам, которые действием избытка аммиака превращаются в соответствующие ω-аминокислоты, например:
Этим путем получается ω-аминоэнантовая кислота — исходный продукт для получения синтетического волокна энант (А. Н. Несмеянов, Р. X. Фрейдлина и др.).
Видео:Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать

Аминокислоты получение и химические свойства
Предлагаем вашему вниманию статью на тему: «Аминокислоты получение и химические свойства» от профессиональных спортсменов, их тренеров и врачей. Статья будет полезна как новичкам, так и опытным спортсменам. Все вопросы можно задать в комментариях или на странице контактов.
Аминокислотами называются органические соединения, содержащие в молекуле функциональные группы: амино- и карбоксильную.
Номенклатура аминокислот. По систематической номенклатуре названия аминокислот образуются из названий соответствующих карбоновых кислот и добавления слова «амино». Положение аминогруппы указывают цифрами. Отсчет ведется от углерода карбоксильной группы.
Изомерия аминокислот. Их структурная изомерия определяется положением аминогруппы и строением углеродного радикала. В зависимости от положенияNH2-группы различают-,- и-аминокислоты.
Из -аминокислот строятся молекулы белка.
Для них также характерна изомерия функциональной группы (межклассовыми изомерами аминокислот могут быть сложные эфиры аминокислот или амиды гидроксикислот). Например, для 2-аминопропановой кислоты СН3–СН(NH)2–COOHвозможны следующие изомеры
Физические свойства α-аминокислот
Аминокислоты – бесцветные кристаллические вещества, нелетучие (малое давление насыщенного пара), плавящиеся с разложением при высоких температурах. Большинство их хорошо растворимо в воде и плохо в органических растворителях.
Водные растворы одноосновных аминокислот имеют нейтральную реакцию. -Аминокислоты можно рассматривать как внутренние соли (биполярные ионы):+NH3CH2COO. В кислой среде они ведут себя как катионы, в щелочной – как анионы. Аминокислоты являются амфотерными соединениями, проявляющими одновременно кислотные и основные свойства.
Способы получения -аминокислот
1. Действие аммиака на соли хлорзамещенных кислот.
ClCH2COONH4 + NH3
2. Действие аммиака и синильной кислоты на альдегиды.
3. Гидролизом белков получают 25 различных аминокислот. Разделение их – очень не простая задача.
Способы получения -аминокислот
1. Присоединение аммиака к непредельным карбоновым кислотам.
СН2=СНСООН + 2NH3 NH2CH2CH2COONH4.
2. Синтез на базе двухосновной малоновой кислоты.
Химические свойства аминокислот
1. Реакции по карбоксильной группе.
1.1. Образование эфиров при действии спиртов.
2. Реакции по аминогруппе.
2.1. Взаимодействие с минеральными кислотами.
NH2CH2COOH + HCl H3N+CH2COOH + Cl
2.2. Взаимодействие с азотистой кислотой.
NH2CH2COOH + HNO2 HOCH2COOH + N2 + H2O
3. Превращение аминокислот при нагревании.
3
.1.-аминокислоты образуют циклические амиды.
3.2.-аминокислоты отщепляют аминогруппу и атом водорода у-углеродного атома.
Глицин NH2CH2COOH(гликокол). Одна из наиболее распространенных аминокислот, входящих в состав белков. При обычных условиях – бесцветные кристаллы с Тпл= 232236С. Хорошо растворима в воде, нерастворима в абсолютном спирте и эфире. Водородный показатель водного раствора6,8; рКа= 1,51010; рКв= 1,71012.
-аланин – аминопропионовая кислота
Широко распространена в природе. Встречается в свободном виде в плазме крови и в составе большинства белков. Тпл= 295296С, хорошо растворима в воде, плохо в этаноле, нерастворима в эфире. рКа(СООН)= 2,34; рКа(NH
-аланин NH2CH2CH2COOH– мелкие кристаллы с Тпл= 200С, хорошо растворима в воде, плохо в этаноле, нерастворима в эфире и ацетоне. рКа(СООН) = 3,60; рКа(NH
) = 10,19; в белках отсутствует.
Комплексоны. Этот термин используют для названия ряда -аминокислот, содержащих две или три карбоксильные группы. Наиболее простые:
Наиболее распространенный комплексон – этилендиаминтетрауксусная кислота.
Ее динатриевая соль – трилон Б – чрезвычайно широко применяется в аналитической химии.
Связь между остатками -аминокислот называют пептидной, а сами образующиеся соединения пептидами.
Два остатка -аминокислот образуют дипептид, три – трипептид. Много остатков образуют полипептиды. Полипептиды, как и аминокислоты, амфотерны, каждому свойственна своя изоэлектрическая точка. Белки — полипептиды.
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Аминокислоты
Общую формулу простейших аминокислот можно записать так:
ПолучениеАминокислоты можно получить из карбоновых кислот, заместив в их радикале атом водорода на галоген, а затем на аминогруппу при взаимодействии с аммиаком. Смесь аминокислот обычно получают кислотным гидролизом белков.
СвойстваАминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.[1]
Группа —СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты. С сильными кислотами — как основания-амины.
Кроме того, аминогруппа в молекуле аминокислоты вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от состава радикала R— они могут быть сладкими, горькими или безвкусными.
Аминокислоты обладают оптической активностью, так как содержат атомы углерода (асимметрические атомы), связанные с четырьмя различными заместителями (исключение составляет амино-уксусная кислота — глицин). Асимметрический атом углерода обозначают звездочкой.
Как вы уже знаете, оптически активные вещества встречаются в виде пар антиподов-изомеров, физические и химические свойства которых одинаковы, за исключением одного — способности вращать плоскость поляризованного луча в противоположные стороны. Направление вращения плоскости поляризации обозначается знаком (+) — правое вращение, (-) — левое вращение.
Различают D-аминокислоты и L-аминокислоты. Расположение аминогруппы NH2 в проекционной формуле слева соответствует L-конфигурации, а справа — D-конфигурации. Знак вращения не связан с принадлежностью соединения к L- или D-ряду. Так, L-ce-рин имеет знак вращения (-), а L-аланин — (+).
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, так как они не синтезируются в организме человека. Незаменимыми являются такие аминокислоты, как валин, лейцин, изолейцин, фени-лалалин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей (табл. 7). Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки—NH—СО—, например:
К ним, кроме названного выше синтетического волокна капрон, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул (подумайте почему).
Таблица 7. Суточная потребность организма человека в аминокислотах
| Видео (кликните для воспроизведения). |
Полиамиды а-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиди, трипептиды, полипептиды. В таких соединениях группы —NР—СО— называют пептидными.
Изомерия и номенклатураИзомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы. Широко распространены также названия аминокислот, в которых положения аминогруппы обозначаются буквами греческого алфавита. Так, 2-аминобутановую кислоту можно назвать также а-аминомасляной кислотой:
1. Запишите уравнения реакций аминопропионовой кисло-; ты с серной кислотой и гидроксидом натрия, а также с метиловым спиртом. Всем веществам дайте названия по международной номенклатуре.
2. Почему аминокислоты являются гетерофункциональными соединениями?
3. Какими особенностями строения должны обладать аминокислоты, используемые для синтеза волокон, и аминокислоты, участвующие в биосинтезе белков в клетках живых организмов?
4. Чем отличаются реакции поликонденсации от реакций полимеризации? В чем их сходство?
5. Как получают аминокислоты? Запишите уравнения реакций получения аминопропионовой кислоты из пропана.
6. Определите строение а-аминокислоты, если известно, что она содержит 15,73% азота.
7*. Смесь массой 30 г, содержащая аминоуксусную кислоту и уксусный альдегид, для солеобразования требует 5,38 л хлороводорода (н. у.) или 10,08 г оксида кальция. Определите массовые доли веществ в исходной смеси.
содержание урока химии 10 класса, риторические и дискуссионные вопросы по химии, библиотека учебников для скачки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний — Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов — гиперссылка).
edufuture.biz 2008-2019© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других «взрослых» тем.
Гипермаркет знаний 2008-2019
Ждем Ваши замечания и предложения на email:
По вопросам рекламы и спонсорства пишите на email:
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Аминокислоты
Общую формулу простейших аминокислот можно записать так:
ПолучениеАминокислоты можно получить из карбоновых кислот, заместив в их радикале атом водорода на галоген, а затем на аминогруппу при взаимодействии с аммиаком. Смесь аминокислот обычно получают кислотным гидролизом белков.
СвойстваАминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.[1]
Группа —СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты. С сильными кислотами — как основания-амины.
Кроме того, аминогруппа в молекуле аминокислоты вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от состава радикала R— они могут быть сладкими, горькими или безвкусными.
Аминокислоты обладают оптической активностью, так как содержат атомы углерода (асимметрические атомы), связанные с четырьмя различными заместителями (исключение составляет амино-уксусная кислота — глицин). Асимметрический атом углерода обозначают звездочкой.
Как вы уже знаете, оптически активные вещества встречаются в виде пар антиподов-изомеров, физические и химические свойства которых одинаковы, за исключением одного — способности вращать плоскость поляризованного луча в противоположные стороны. Направление вращения плоскости поляризации обозначается знаком (+) — правое вращение, (-) — левое вращение.
Различают D-аминокислоты и L-аминокислоты. Расположение аминогруппы NH2 в проекционной формуле слева соответствует L-конфигурации, а справа — D-конфигурации. Знак вращения не связан с принадлежностью соединения к L- или D-ряду. Так, L-ce-рин имеет знак вращения (-), а L-аланин — (+).
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, так как они не синтезируются в организме человека. Незаменимыми являются такие аминокислоты, как валин, лейцин, изолейцин, фени-лалалин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей (табл. 7). Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки—NH—СО—, например:
К ним, кроме названного выше синтетического волокна капрон, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул (подумайте почему).
Таблица 7. Суточная потребность организма человека в аминокислотах
Полиамиды а-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиди, трипептиды, полипептиды. В таких соединениях группы —NР—СО— называют пептидными.
Изомерия и номенклатураИзомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы. Широко распространены также названия аминокислот, в которых положения аминогруппы обозначаются буквами греческого алфавита. Так, 2-аминобутановую кислоту можно назвать также а-аминомасляной кислотой:
1. Запишите уравнения реакций аминопропионовой кисло-; ты с серной кислотой и гидроксидом натрия, а также с метиловым спиртом. Всем веществам дайте названия по международной номенклатуре.
2. Почему аминокислоты являются гетерофункциональными соединениями?
3. Какими особенностями строения должны обладать аминокислоты, используемые для синтеза волокон, и аминокислоты, участвующие в биосинтезе белков в клетках живых организмов?
4. Чем отличаются реакции поликонденсации от реакций полимеризации? В чем их сходство?
5. Как получают аминокислоты? Запишите уравнения реакций получения аминопропионовой кислоты из пропана.
6. Определите строение а-аминокислоты, если известно, что она содержит 15,73% азота.
7*. Смесь массой 30 г, содержащая аминоуксусную кислоту и уксусный альдегид, для солеобразования требует 5,38 л хлороводорода (н. у.) или 10,08 г оксида кальция. Определите массовые доли веществ в исходной смеси.
содержание урока химии 10 класса, риторические и дискуссионные вопросы по химии, библиотека учебников для скачки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний — Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов — гиперссылка).
edufuture.biz 2008-2019© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других «взрослых» тем.
Гипермаркет знаний 2008-2019
Ждем Ваши замечания и предложения на email:
По вопросам рекламы и спонсорства пишите на email:
| Видео (кликните для воспроизведения). |
Источники:
- Педагогика физический культуры и спорта. Учебник. — М.: Физическая культура, 2013. — 528 c.
- Villanova Regimen sanitatis Salernitanum. Салернский кодекс здоровья / Villanova, Arnaldi De; Вилланова, Арнольд Де. — М.: Colonia, 1507. — 100 c.
Приветствую вас! на нашем портале. Я Сергей Муратов. Я уже более 5 лет работаю продавцом-консультантом в магазине спортивного питания. В настоящее время являюсь профессионалом в своей области, хочу подсказать всем посетителям сайта как решать сложные и не очень задачи.
Все данные для сайта собраны и тщательно переработаны для того чтобы донести в доступном виде всю необходимую информацию. Однако чтобы применить все, описанное на сайте всегда необходима ОБЯЗАТЕЛЬНАЯ консультация с профессионалами.
📹 Видео
Аминокислоты. 1 часть. 11 класс.Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Лекция получение аминокислот (ур.10 кл)Скачать

Аминокислоты. 3 часть. 11 класс.Скачать

Способы получения аминов | Химия ЕГЭ 10 класс | УмскулСкачать

108. Химические свойства аминокислотСкачать

Химия. АминокислотыСкачать

Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

Химия 10 класс (Урок№12 - Аминокислоты. Белки.)Скачать

Аминокислоты. 2 часть. 11 класс.Скачать

Реакции на аминогруппуСкачать

Аминокислоты | Химия ЕГЭ 10 класс | УмскулСкачать

3.2. Алкины: Способы полученияСкачать

4.2. Алкадиены (диены): Способы получения. ЕГЭ по химииСкачать

МАГИЯ в Химии — Способы Получения АлкеновСкачать

64. Аминокислоты и Белки (практика)Скачать

АМИНОКИСЛОТЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать