- Оксид кремния (IV)
- Физические свойства и нахождение в природе
- Химические свойства
- Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF?
- Уравнения возможных реакций HCL, AL(OH)3 , NA , CaO, NaOH, SO2, MG, NA2SO4?
- Закончить уравнение возможных реакций Na2O + CO2 = Li2O + CaO = NaOH + SO3 = MgO + HCl = SO2 + H2SO4 = P2O5 + SO3 = CaO + HOH =?
- Запишите уравнения всех возможных реакций между веществами : NaOH, Cu, CaO, HNO3,SO,?
- Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами, формулы которых?
- Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF?
- Составьте молекулярное уравнение реакций оксида серы lV с веществами : H2O ; CaO ; NaOH?
- Напишите уравнения реакции : NaOH + HCl = Ca + H2SO4 = P2O5 + Ca(OH) = N2O5 + CaO = CaO + HCL =?
- Написать все возможные реакции между этими веществами : Zn, CaO, H2O, C, HCL, NaOH, H2SO4, BaCL2, CuSO4?
- С какими веществами взаимодействует оксид кремния (IV)?
- Дописать возможные уравнения реакции, и назвать полученное вещество а)Fe2O + HCL→ б)Cu + H3PO4→ в)ZnCL2 + NaOH→ г)Na2SO4Ag→ д)CaO + SO3→?
- Кремний
- 📺 Видео
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF?
Химия | 5 — 9 классы
Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF.
SiO2 + 2NaOH — — > ; Na2SiO3 + H2O
SiO2 + H2O — — > ; H2SiO3
SiO2 + CaO — — > ; CaSiO3
SiO2 + CaCO3 — — > ; реакция не идет
SiO2 + HCl — — > ; реакция не идет
SiO2 + HF — — > ; реакция не идет.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Уравнения возможных реакций HCL, AL(OH)3 , NA , CaO, NaOH, SO2, MG, NA2SO4?
Уравнения возможных реакций HCL, AL(OH)3 , NA , CaO, NaOH, SO2, MG, NA2SO4.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Закончить уравнение возможных реакций Na2O + CO2 = Li2O + CaO = NaOH + SO3 = MgO + HCl = SO2 + H2SO4 = P2O5 + SO3 = CaO + HOH =?
Закончить уравнение возможных реакций Na2O + CO2 = Li2O + CaO = NaOH + SO3 = MgO + HCl = SO2 + H2SO4 = P2O5 + SO3 = CaO + HOH =.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Запишите уравнения всех возможных реакций между веществами : NaOH, Cu, CaO, HNO3,SO,?
Запишите уравнения всех возможных реакций между веществами : NaOH, Cu, CaO, HNO3,
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами, формулы которых?
Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами, формулы которых.
Задание во вложении!
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF?
Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Составьте молекулярное уравнение реакций оксида серы lV с веществами : H2O ; CaO ; NaOH?
Составьте молекулярное уравнение реакций оксида серы lV с веществами : H2O ; CaO ; NaOH.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Напишите уравнения реакции : NaOH + HCl = Ca + H2SO4 = P2O5 + Ca(OH) = N2O5 + CaO = CaO + HCL =?
Напишите уравнения реакции : NaOH + HCl = Ca + H2SO4 = P2O5 + Ca(OH) = N2O5 + CaO = CaO + HCL =.
Видео:ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать

Написать все возможные реакции между этими веществами : Zn, CaO, H2O, C, HCL, NaOH, H2SO4, BaCL2, CuSO4?
Написать все возможные реакции между этими веществами : Zn, CaO, H2O, C, HCL, NaOH, H2SO4, BaCL2, CuSO4.
Видео:Составление уравнений реакций. 1 часть. 9 класс.Скачать
С какими веществами взаимодействует оксид кремния (IV)?
С какими веществами взаимодействует оксид кремния (IV)?
А) H2O б) NaOH в) Na2CO3 г) CaO.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Дописать возможные уравнения реакции, и назвать полученное вещество а)Fe2O + HCL→ б)Cu + H3PO4→ в)ZnCL2 + NaOH→ г)Na2SO4Ag→ д)CaO + SO3→?
Дописать возможные уравнения реакции, и назвать полученное вещество а)Fe2O + HCL→ б)Cu + H3PO4→ в)ZnCL2 + NaOH→ г)Na2SO4Ag→ д)CaO + SO3→.
Вопрос Составьте возможные уравнения реакций между оксидом кремния (IV) и веществами : 1) NaOH 2) H2O 3) CaO 4) CaCO3 5) HCl 6) HF?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 5 — 9 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Железная стружка, кварцевый песок, хлорид натрия. 1) Железная стружка вытягивается магнитом. 2) Остаток разбавляется водой. Песок оседает. Соль растворяется. 3) Раствор сливается и выпаривается до твердого остатка — соли.
CO2 — кислотный оксид. С кислотным оксидом и водой реагирует основный оксид, которому соответствует растворимое основание. Al2O3 — амфотерный оксид, P2O5 — кислотный оксид, Li2O — основный оксид, которому соответствует растворимое основание LiOH Cu..
CaO + CO2 = CaCO3 Так запиши.
Na + H2O = > NaOH + H2O. + Q или + 281кДж экзотермическая реакция.
1. Химические 2. Физические 3. Химические 4. Физические 5. Физические.
N(hcl) = 112 / 22. 4 = 5моль n = m / M m = n * M m = 36, 5 * 5 = 182, 5г.
Надеюсь правильно. Примного извиняюсь за ошибки(シ_ _)シ.
Ответ смотри в фотографии.
Вот, только в последней реакции есть сомнения насчёт того, как уравнять : скореесли всего, не надо ставить ппред остром цинка двойку.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
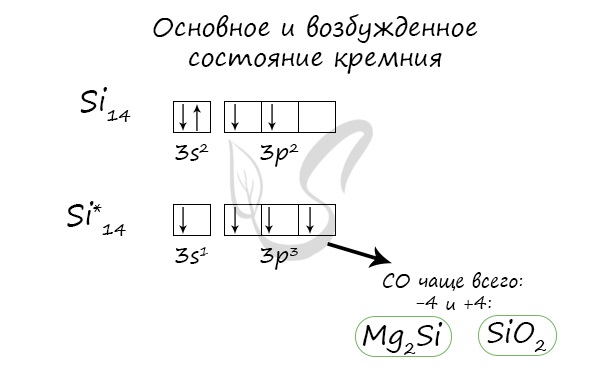
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
📺 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Проклятая химическая реакция 😜 #shortsСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать