- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Теория электролитической диссоциации
- Просмотр содержимого презентации «ТЭЛД»
- Растворы электролитов
- Электролиты
- Теория электролитической диссоциации
- Ионно–молекулярные уравнения
- Как составить полное и сокращенное ионные уравнения
- Условия протекания реакции (химического превращения)
- Составьте возможные уравнения электролитической диссоциации веществ в водных растворах hcl hno3
- 💥 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

We are checking your browser. gomolog.ru
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70884f4a8d969707 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Теория электролитической диссоциации
Материал содержит информацию об основных положениях Теории электролитической диссоциации
Просмотр содержимого презентации
«ТЭЛД»
МБОУ «Бутовская СОШ»
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Урок в 8 классе
- Сформулировать основные положения теории электролитической диссоциации
- Научиться записывать процесс диссоциации при помощи химических знаков и формул
- Обобщить сведения об ионах
История создания теории электролитической диссоциации
Аррениус Алексеевич Александрович
Основные положения ТЭД
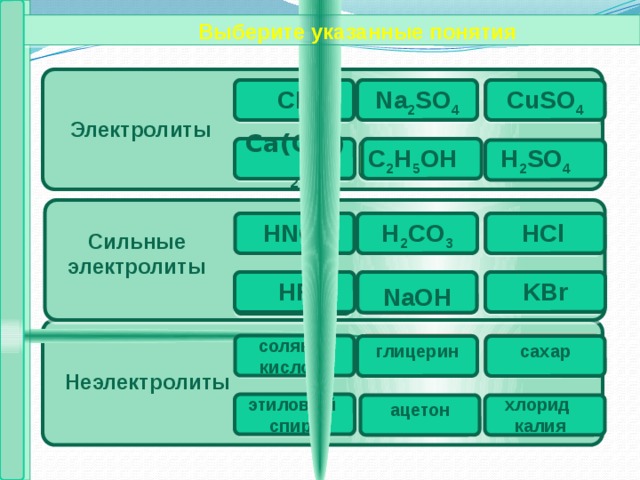
1. Вещества делятся на электролиты и неэлектролиты .
Электролиты – вещества, проводящие электрический ток через свои растворы .
Неэлектролиты – вещества, не проводящие электрический ток через свои растворы.
Основные положения ТЭД
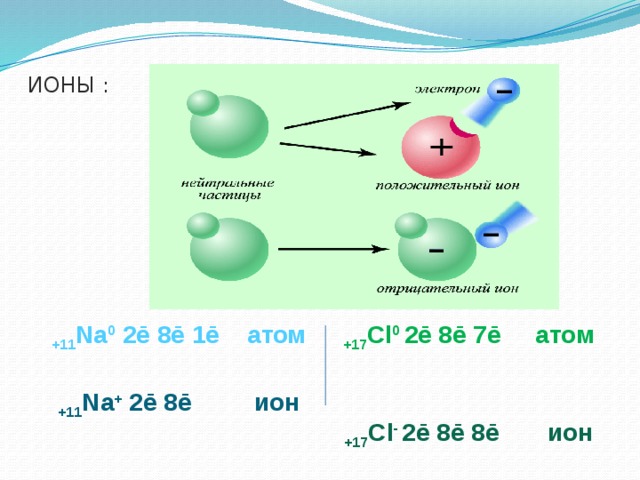
2. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы – это одна из форм существования химического элемента
Основные положения ТЭД
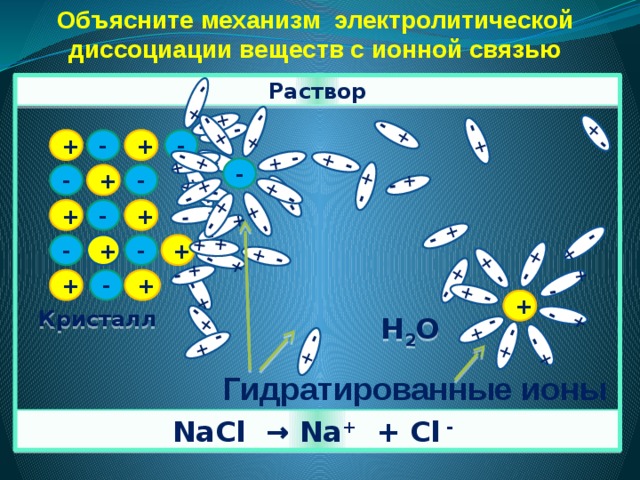
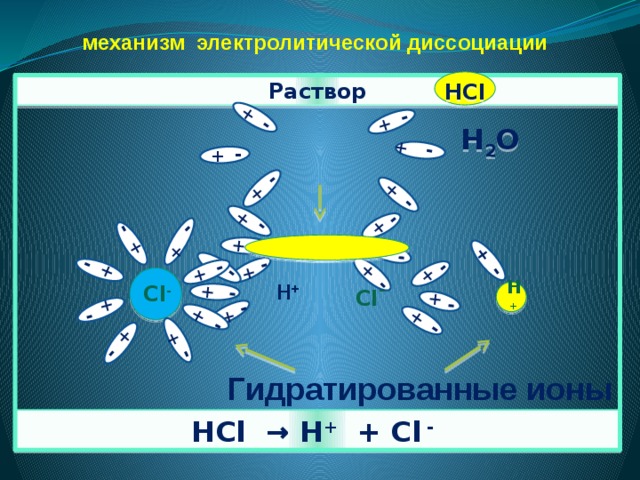
3. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
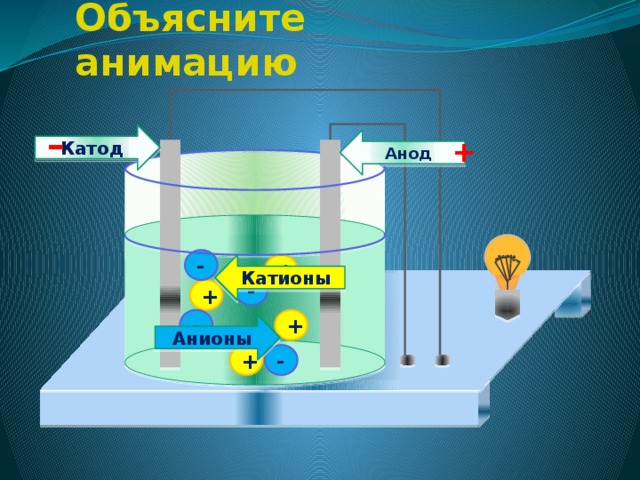
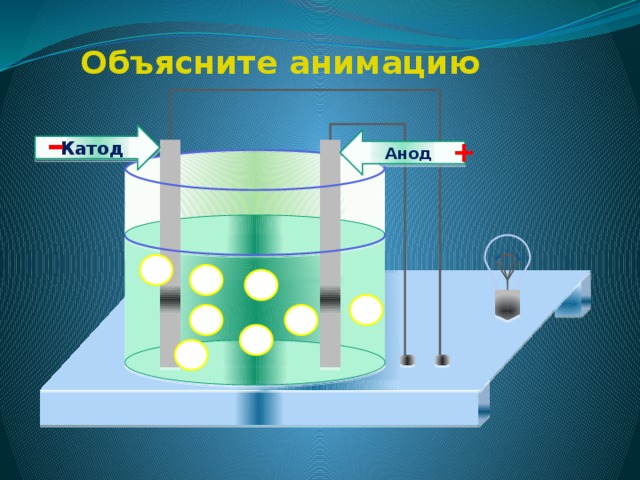
Объясните механизм электролитической диссоциации веществ с ионной связью
механизм электролитической диссоциации
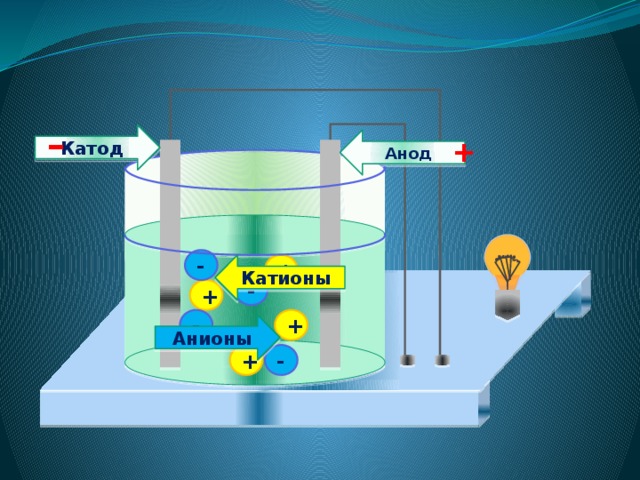
4. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока – катоду , поэтому их называют катионами , а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду , поэтому их называют анионами .
ИОНЫ (по составу)
ИОНЫ (по знаку заряда)
положительно заряженные частицы
отрицательно заряженные частицы
Основные положения ТЭД
4. Электролитическая диссоциация – процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации протекает и обратный процесс – ассоциация (соединение ионов)
Повторите значение слов
Основные положения ТЭД
5. Не все электролиты в одинаковой мере диссоциируют на ионы.
Вопрос: Что означает выражение: «Степень диссоциации кислоты 25%»?
Основные положения ТЭД
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
- электролиты, которые при диссоциации образуюткатионыводорода ианионыкислотного остатка.
Многоосновные кислоты диссоциируют ступенчато
1) Образование дигидрофосфат-ионов
2) Образование гидрофосфат-ионов
3) Образование фосфат-ионов
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
- электролиты, которые при диссоциации образуюткатионыметалла и гидроксид-анионы.
Многокислотные основания диссоциируют ступенчато
1) Образование гидроксоионов бария
2) Образование ионов бария
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
электролиты, которые при диссоциации образуют катионы металла (или аммония NH 4 ) и анионы кислотных остатков.
Выберите указанные понятия
Заполните пропуски в предложениях:
- При растворении в воде электролиты диссоциируют (распадаются) на …………………… .
- Причиной диссоциации электролита в водном растворе является его ………………………………… , т.е. взаимодействие с молекулами воды.
- Ионы это — …………………………………………………………………………………
- Под действием электрического тока положительно заряженные ионы двигаются к ……………………… , отрицательно заряженные ионы двигаются к ………………………… .
- Электролитическая диссоциация – процесс ………………………… .для слабых электролитов.
- Кислоты при диссоциации в растворах распадаются на катионы …………………… . и анионы ……………………………………………
- Основания при диссоциации в растворах распадаются на катионы …………………… . и анионы ……………………………………………
- Соли при диссоциации в растворах распадаются на катионы …………………… . и анионы ……………………………………………
- § 36, выучить наизусть положения ТЭД;
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Растворы электролитов
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Электролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
- Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.
- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α — + bB +
K = [A — ] a ·[B + ] b /[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α 2 C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α 2 C
Отсюда нетрудно найти степень диссоциации
α = (K/C) 1/2
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H + + Cl — +Na + + OH — = Na + + Cl — + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H + + OH — = HOH
Мы видим, что процесс нейтрализации сводится к соединению H + и OH — и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
Молекулярное уравнение AgNO3 + HI →AgI↓ + HNO3 Полное ионное уравнение Ag + + NO3 — + H + + I — →AgI↓ + H + + NO3 — Сокращенное ионное уравнение Ag + + I — →AgI↓ Процесс осаждения сводится к взаимодействию только Ag + и I — и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
Молекулярное уравнение Na2SO3 + 2HI → 2NaI + SO2↑ + H2O Полное ионное уравнение 2Na + + SO3 2- + 2H + + 2I — → 2Na + + 2I — + SO2↑ + H2O Сокращенное ионное уравнение SO3 2- + 2H + → SO2↑ + H2O Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
Молекулярное уравнение CaCl2 + 2NaI = 2NaCl +CaI2 Полное ионное уравнение Ca 2+ + Cl — + 2Na + + I — = 2Na + + Cl — + Ca 2+ + 2I — Сокращенное ионное уравнение отсутствует Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита. В качестве неэлектролита может выступать вода.
- Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать
Составьте возможные уравнения электролитической диссоциации веществ в водных растворах hcl hno3
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!Задание 1
Какие вещества называют электролитами? Электролитами называют вещества, растворы и расплавы которых проводят электрический ток.Задание 2
Что называют электролитической диссоциацией? Процесс распада молекулы электролита на ионы при растворении в воде.Задание 3
Что называют степенью электролитической диссоциации? Степенью электролитической диссоциации α (читается «альфа») называют отношение количества вещества электролита, распавшегося на ионы (nд), к общему количеству растворённого вещества (nр):
α=nд/nр.
На какие группы делятся вещества по степени электролитической диссоциации? На сильные и слабые электролиты. В сильных электролитах (они диссоциируют необратимо) степень электролитической диссоциации α стремится к 100% , а в слабых электролитах (они диссоциируют обратимо) ― к 0%.
Задание 4
От каких факторов зависит степень электролитической диссоциации? От природы электролита и его концентрации в растворе (выше в разбавленном растворе).Задание 5
Почему кристаллический хлорид натрия не проводит электрический ток, а его раствор электропроводен? Ионы, содержащиеся в кристаллическом (твердом) веществе, расположенные в узлах кристаллической решетки, соединенные друг с другом и перемещаться не могут, поэтому твердые электролиты электрический ток не проводят. Натрий хлорид при растворении в воде распадается на ионы (положительные Na + и отрицательные Cl — ) , что способны свободно передвигаться, и являются носителями зарядов. Под воздействием электрического поля движение ионов становится направленным (возникает электрический ток) .
Объясните механизм диссоциации соли. Если кристалл соли поместить в воду, то вокруг положительных и отрицательных ионов кристаллической решётки электролита диполи воды сориентируются противоположно заряженными концами. Между ионами кристалла соли и молекулами воды возникнет притяжение, связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Перешедшие в раствор ионы остаются связанными с присоединившимися к ним молекулами воды, которые образуют гидратную оболочку иона, то есть в растворе содержатся гидратированные ионы соли.Задание 6
Можно ли говорить о процессе ассоциации в растворах электролитов с ионной ковалентной связью? Почему? Можно, т.к. в растворы слабых электролитов диссоциируют обратимо.Задание 7
Напишите уравнения электролитической диссоциации следующих веществ: хлорида железа (III), сероводородной кислоты, сульфата железа (II), фосфата натрия, гидроксида бария, азотистой кислоты, азотной кислоты.
FeCl3 = Fe 3+ + 3Cl —
H2S ⇄ 2H + + S 2-
FeSO4 = Fe 2+ + SO4 2-
Na3PO4 = 3Na + + PO4 3-
Ba(OH)2 = Ba 2+ + 2OH —
HNO2 ⇄ H + + NO2—
HNO3 = H + + NO3 —
Почему в одних уравнениях вы записываете знак равенства, а в других — знак обратимости? Среди предложенных веществ есть как сильные электролиты (они диссоциируют необратимо) , так и слабые (они диссоциируют обратимо) .Задание 8
Чему равна сумма коэффициентов перед формулами ионов в уравнениях электролитической диссоциации:
а) нитрата железа (III); Четыре
Fe(NO3)3 = Fe 3+ + 3NO3 — 1+3=4
б) хлорида алюминия; Четыре
AlCl3 = Al 3+ + 3Cl — 1+3=4
в) нитрита калия; Два
KNO2 = K + + NO2 — 1+1=2
г) сульфата аммония? Два
(NH4)2SO4 = 2NH4 + + SO4 -2 2+1=3Задание 9
В растворах каких соединений загорится лампочка при испытании их на электропроводность:
а) сероводород; Загорится
б) азотистая кислота; Загорится
в) гидроксид бария; Загорится
г) гидрат аммиака;
д) серная кислота; Загорится
е) сульфат магния? Загорится
Где она будет гореть ярко, а где — слабо? Ярко: в), д), е), а слабо: а), б).
Как можно увеличить интенсивность горения лампочки? Разбавить раствор.
При разбавлении раствора степень электролитической диссоциации увеличивается, так как при неизменном количестве растворённого вещества увеличивается число диполей воды, которые в разбавленном растворе могут провзаимодействовать с большим количеством молекул вещества, образуя ионы.Задание 10
Найдите количество вещества каждого из ионов, содержащихся в 342 г 5%-ного раствора сульфата алюминия.
Дано: w(Al2(SO4)3)=5%, m(раствора)=342 г
Найти: n(Al 3 + )-?, n(SO4 2- )-?
Решение
1. Рассчитаем массу растворённого сульфата алюминия в растворе:
m(Al2(SO4)3)=w(Al2(SO4)3)•m(раствора):100%=5%•342 г:100%=17,1 г
2. Количество вещества заданной массы рассчитываем по формуле: n=m/M, где M ― молярная масса.
Mr(Al2(SO4)3)= 2•Ar(Al)+3•Ar(S)+12•Ar(O)=2•27+3•32+12•16=342, M(Al2(SO4)3)=342 г/моль
ʋ(Al2(SO4)3)=m(Al2(SO4)3)/M(Al2(SO4)3)=17,1 г : 342 г/моль=0,05 моль
3. Уравнение диссоциации сульфата алюминия:
Al2(SO4)3 = 2Al 3 + +3SO4 2-
В 1 моль сульфата алюминия Al2(SO4)3 содержится 2 моль ионов алюминия Al 3+ и 3 моль анионов кислотного остатка SO4 2- , а в 0,05 моль сульфата алюминия содержится :
n(Al 3+ )=2•n(Al2(SO4)3)=2•0,05 моль=0,1 моль
n(SO4 2- )=3•n(Al2(SO4)3)=3•0,05 моль=0,15 моль
Ответ: n(Al 3+ )=0,1 моль, n(SO4 2- )=0,15 мольДополнительное задание
Подготовьте сообщение о жизни и творчестве С. Аррениуса. Самостоятельно.
💥 Видео
Электролитическая диссоциация электролитов в водных растворах. Химия ЕГЭСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Химия 9 класс (Урок№5 - Сущность процесса электролитической диссоциации.)Скачать

Механизм электролитической диссоциации. 9 класс.Скачать

Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

Тема 15. Электролитическая диссоциация веществ в растворахСкачать

Механизм электролитической диссоциацииСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать