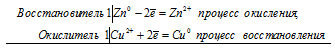Химия | 5 — 9 классы
Напишите уравнение реакции между : цинком и сульфатом меди(II), медью и нитратом серебра,
алюминием и раствором серной кислоты, пожалуйста.
Zn + CuSO4 = ZnSO4 + CuCu + 2AgNO3 = Cu(NO3)2 + 2Ag2Al + 3H2SO4 = Al2(SO4)3 + 3H2.
- Напишите молекулярное и ионные уравнения реакций между растворами : а)соляной кислоты и нитрата серебра : б)хлорида бария и сульфата меди(||)?
- В водном растворе будут протекать реакции А) железо + сульфат меди (II) Б) медь + нитрат серебра (I) В) цинк + нитрат свинца (II) Г) медь + сульфат цинка Д) цинк + сульфат магния?
- 2. Запишите в молекулярной и ионной форме уравнения реакции взаимодействия предложенных веществ : Варианты : 1?
- Напишите полные и сокращённые ионные уравнения реакций между растворами : а) сульфата калия и хлорида бария ;б) фосфорной кислоты и нитрата серебра ;в) сульфата алюминия и гидроксида калия?
- Вам даны металлы : железо, свинец, медь, алюминий и соли : хлорид меди(2), нитрат свинца(2), нитрат серебра и сульфат цинка?
- Какую реакцию среды имеет водный раствор сульфата алюминия, хлорида цинка, нитрата калия?
- Напишите уравнения реакций, укажите тип реакции : 1?
- Напишите уравнения реакций взаимодействия железа с растворами : а) серной кислоты ; б) сульфата меди (II) ; в) бромоводородной кислоты ; г) нитрата свинца?
- Реакция замещения :Барий + фосфорная кислота =Алюминий + серная кислота =Серебро + угольная кислота =Цинк + сульфат железа(2) =Магний + хлорид хрома(3) =Цинк + нитрат меди(2) =?
- Составить уравнение реакций взаимодействия а)меди с кислородом б) железа с хлором в) бария с водой г) алюминия с нитратом свинца д) цинка с раствором серной кислоты?
- Составьте уравнения возможных реакций между сульфатом меди 2 и цинком серебром
- Процессы коррозии различных металлов. Интенсивность коррозии
- Решение задач по химии на коррозию металлов
- а) Электрохимические процессы при реакции цинка и сульфата меди
- б) Электрохимические процессы при реакции железа и сульфата меди
- Реакция взаимодействия цинка и сульфата меди (II)
- Реакция взаимодействия цинка и сульфата меди (II)
- Реакция взаимодействия свинца, серной кислоты и кислорода
- Реакция взаимодействия оксида германия (IV) и водорода
- Реакция взаимодействия гидроксида калия и оксида серы (IV)
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- 🌟 Видео
Видео:Реакция сульфата меди CuSO4 с цинкомСкачать

Напишите молекулярное и ионные уравнения реакций между растворами : а)соляной кислоты и нитрата серебра : б)хлорида бария и сульфата меди(||)?
Напишите молекулярное и ионные уравнения реакций между растворами : а)соляной кислоты и нитрата серебра : б)хлорида бария и сульфата меди(||)?
Видео:Взаимодействие цинка с сульфатом меди (II) I ЕГЭ по химииСкачать

В водном растворе будут протекать реакции А) железо + сульфат меди (II) Б) медь + нитрат серебра (I) В) цинк + нитрат свинца (II) Г) медь + сульфат цинка Д) цинк + сульфат магния?
В водном растворе будут протекать реакции А) железо + сульфат меди (II) Б) медь + нитрат серебра (I) В) цинк + нитрат свинца (II) Г) медь + сульфат цинка Д) цинк + сульфат магния.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

2. Запишите в молекулярной и ионной форме уравнения реакции взаимодействия предложенных веществ : Варианты : 1?
2. Запишите в молекулярной и ионной форме уравнения реакции взаимодействия предложенных веществ : Варианты : 1.
Нитрат серебра и соляная кислота ; Хлорид бария и серная кислота ; Карбонат кальция и соляная кислота 2.
Сульфат алюминия и гидроксид натрия ; Гидроксид калия и Сульфат меди Оксид меди (11) и серная кислота 3.
Карбонат натрия и соляная кислота ; Цинк и серная кислота ; Нитрат бария и Сульфат натрия 4.
Сульфат меди (11) и гидроксид натрия ; Хлорид железа (111) и гидроксид калия ; Хлорид кальция и Нитрат серебра 5.
Оксид меди (11) и серная кислота ; Хлорид цинка и серная кислота ; Хлорид цинка и гидроксид натрия 6.
Нитрат бария и Сульфат калия ; Гидроксид натрия и Нитрат цинка ; соляная кислота и Карбонат кальция.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Напишите полные и сокращённые ионные уравнения реакций между растворами : а) сульфата калия и хлорида бария ;б) фосфорной кислоты и нитрата серебра ;в) сульфата алюминия и гидроксида калия?
Напишите полные и сокращённые ионные уравнения реакций между растворами : а) сульфата калия и хлорида бария ;
б) фосфорной кислоты и нитрата серебра ;
в) сульфата алюминия и гидроксида калия.
Видео:Химическая реакция цинка и медного купоросаСкачать

Вам даны металлы : железо, свинец, медь, алюминий и соли : хлорид меди(2), нитрат свинца(2), нитрат серебра и сульфат цинка?
Вам даны металлы : железо, свинец, медь, алюминий и соли : хлорид меди(2), нитрат свинца(2), нитрат серебра и сульфат цинка.
Осуществите возможные реакции замещения, напишите уравнения реакций.
Видео:Взаимодействие железа с сульфатом медиСкачать

Какую реакцию среды имеет водный раствор сульфата алюминия, хлорида цинка, нитрата калия?
Какую реакцию среды имеет водный раствор сульфата алюминия, хлорида цинка, нитрата калия?
Составить уравнение реакции гидролиза сульфата алюминия, хлорида цинка, нитрата калия.
Видео:CuSO4 + NaOH Взаимодействие сульфата меди (II) с гидроксидом натрия в водном раствореСкачать

Напишите уравнения реакций, укажите тип реакции : 1?
Напишите уравнения реакций, укажите тип реакции : 1.
Медь + нитрат серебра = нитрат меди (II) + серебро 2.
Угольная кислота = вода + оксид углерода (IV) 3.
Цинк + серная кислота = сульфат цинка + водород 4.
Фосфат натрия + нитрат кальция = фосфат кальция + нитрат натрия 5.
Гидроксид железа (III) = оксид железа (III) + вода.
Видео:Реакция замещения меди железом в растворе сульфата или хлорида меди IIСкачать

Напишите уравнения реакций взаимодействия железа с растворами : а) серной кислоты ; б) сульфата меди (II) ; в) бромоводородной кислоты ; г) нитрата свинца?
Напишите уравнения реакций взаимодействия железа с растворами : а) серной кислоты ; б) сульфата меди (II) ; в) бромоводородной кислоты ; г) нитрата свинца.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Реакция замещения :Барий + фосфорная кислота =Алюминий + серная кислота =Серебро + угольная кислота =Цинк + сульфат железа(2) =Магний + хлорид хрома(3) =Цинк + нитрат меди(2) =?
Барий + фосфорная кислота =
Алюминий + серная кислота =
Серебро + угольная кислота =
Цинк + сульфат железа(2) =
Магний + хлорид хрома(3) =
Цинк + нитрат меди(2) =.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Составить уравнение реакций взаимодействия а)меди с кислородом б) железа с хлором в) бария с водой г) алюминия с нитратом свинца д) цинка с раствором серной кислоты?
Составить уравнение реакций взаимодействия а)меди с кислородом б) железа с хлором в) бария с водой г) алюминия с нитратом свинца д) цинка с раствором серной кислоты.
На этой странице находится вопрос Напишите уравнение реакции между : цинком и сульфатом меди(II), медью и нитратом серебра,алюминием и раствором серной кислоты, пожалуйста?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 5 — 9 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
В первой картинке — 3 — метилпентан во второй картинке — 3 — метил — 2 — хлоргексан.
Видео:цинк с сульфатом медиСкачать

Составьте уравнения возможных реакций между сульфатом меди 2 и цинком серебром
1) Составьте молекулярное уравнение реакции цинка с раствором сульфата меди(II);
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
Прочитайте следующий текст и выполните задания 5—7.
Сульфат меди(II) — важнейшая из солей меди. Кристаллогидрат сульфата меди(II) называют медным купоросом. В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. В промышленности эту соль применяют в производстве ацетатного волокна, а также используют в качестве фиксатора окраски и консерванта. Сульфат меди(II) в промышленности получают различными способами, например растворением оксида меди(II)
в серной кислоте
Эта соль часто служит исходным сырьём для получения других соединений, например гидроксида меди(II)
Для водного раствора сульфата меди(II) возможна реакция с металлами активнее меди, например с цинком. Сульфат меди(II) является соединением с умеренной токсичностью. Однако работать с порошком или пудрой сульфата меди(II) следует осторожно, не допуская их пыления.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить серная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является сульфат меди (II)
Ответ: Оксид — основание —
кислота —
соль —
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Процессы коррозии различных металлов. Интенсивность коррозии
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Видео:Реакции ионного обмена. 9 класс.Скачать

Реакция взаимодействия цинка и сульфата меди (II)
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Реакция взаимодействия цинка и сульфата меди (II)
Уравнение реакции взаимодействия цинка и сульфата меди (II):
Реакция взаимодействия цинка и сульфата меди (II).
В результате реакции образуются сульфат цинк и медь.
Реакция протекает при нормальных условиях.
Формула поиска по сайту: Zn + CuSO4 → ZnSO4 + Cu.
Реакция взаимодействия свинца, серной кислоты и кислорода
Реакция взаимодействия оксида германия (IV) и водорода
Реакция взаимодействия гидроксида калия и оксида серы (IV)
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
🌟 Видео
Электролиз. 10 класс.Скачать

Решение цепочек превращений по химииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Реакции между растворами электролитов / Реакции ионного обменаСкачать

СУЛЬФАТ МЕДИСкачать