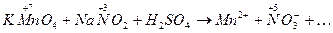Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Решение заданий занятия № 3Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  Решение заданий занятия № 3.(Обоснования и ответы взяты из решения Ольги Эдуардовны Сикорской) Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  1) перманганат калия с нитритом натрия в растворе гидроксида калияВидео:Окисление органических соединений перманганатом калияСкачать  Перманганат калия – окислитель, нитрит натрия – восстановитель, среда щелочная.Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать  В щелочной среде перманганат восстанавливается до манганата калия (схема 1), нитрит окисляется до нитрата.Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  2KMnO4 +NaNO2 + 2KOH = NaNO3+ 2 K2MnO4+ H2OЭто задание все выполнили без ошибок. 2) сероводород с водным раствором хромата калия; Хромат калия – окислитель, сероводород – восстановитель, среда будет близка к нейтральной, так как сероводород – очень слабая кислота, а растворимость сероводорода незначительная. В нейтральной среде хромат восстанавливается до гидроксида хрома (III) (схема 3), а сероводород окисляется до серы (схема 7) 2K2CrO4 + 3H2S + 2H2O = 3S + 2Cr(OH)3 + 4KOH В этом задании были допущены ошибки, некоторые посчитали, что продуктом окисления сероводорода будет сульфат-ион. 3) алюминий с очень разбавленной азотной кислотой (см. таблицу 1) Алюминий – восстановитель, азотная кислота – окислитель. Среда кислая. Согласно таблице 1, азотная кислота восстановится до иона аммония, алюминий окислится до Аl 3+ 8Al +30HNO3 = 3NH4NO3 + 8Al(NO3)3 +9H2O Это задание все выполнили без ошибок. 4) фосфор с концентрированной серной кислотой Фосфор – восстановитель, серная кислота концентрированная – сильный окислитель. Среда кислая. Согласно схеме 6, серная кислота восстановится в SO2 , a фосфор окислится до фосфорной кислоты. 2Р +5Н2SO4(конц) = 5SO2 +2H3PO4 +2H2O В качестве продукта можно было записать метафосфорную кислоту, особенно, если концентрацию серной кислоты считать близкой к 100%. Многие посчитали, что продуктом окисления фосфора будет фосфористая кислота. Возможно, если фосфора избыток, а серной кислоты – недостаток, и она не очень концентрированная, так может получиться. Но фосфористая кислота легко окисляется до фосфорной. Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать  5) сульфит калия с концентрированной азотной кислотойВидео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Cульфит калия — восстановитель, концентрированная азотная кислота – окислитель сильный. Среда кислая.Видео:Разбор всех типов 29-30 заданий из сборника Добротина 2023 | Екатерина СтрогановаСкачать  Согласно схеме 4, концентрированная азотная кислота восстановится до NO2 , а сульфит калия окислится в сульфат калия.Видео:Стандартизация раствора натрия тиосульфата по калия дихроматуСкачать  К2SO3 + 2 HNO3(конц) = К2SO4 +2NO2 +H2OВ некоторых работах как продукт восстановления концентрированной азотной кислоты указан NO. Видео:Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать  6) бромат калия с йодидом калия в сернокислом раствореВидео:Взаимодействие ацетилена с раствором перманганата калияСкачать  Бромат калия – окислитель, иодид калия – восстановитель. Среда кислая. Кислородные соединения галогенов восстанавливаются до галогенид-ионов, галогениды окисляются до свободных галогенов.Видео:Получение кислорода из перманганата калияСкачать  КВrO3 +6KI +3H2SO4 = KBr +3I2 + 3K2SO4 +3H2OНекоторые участники мастер-класса не ограничились материалами лекции, заглянули в справочники и нашли информацию о том, что в кислой среде бромат восстановится до свободного брома: Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  2КВrO3 +10KI +6H2SO4 = Br2 +5I2 + 6K2SO4 +6H2OВозникает вопрос: как правильно? Мы на него не сможем однозначно ответить: это зависит от соотношения реагентов, их концентраций. В заданиях С1 ЕГЭ выполнить задание так, как задумано составителями помогут ключевые вещества, присутствующие в схеме. В целом, при проверке заданий С1 правильным считается решение, соответствующее условию и не противоречащее здравому смыслу. В материалах занятия № 4 вы увидите, что возможно несколько правильных решений одного и того же задания. В этом задании было допущено много ошибок при составлении формулы бромата: ВrO –– гипобромит; ВrO2– – бромит; ВrO3– – бромат; ВrO4 –– пербромат. 7) сульфат железа (II) с концентрированной серной кислотой Cульфат железа (II) –восстановитель, концентрированная серная кислота – окислитель. Среда кислая. Согласно схеме 6, концентрированная серная кислота восстановится до SO2, а сульфат железа (II) окислится в сульфат железа (III). 2FeSO4 + 2H2SO4(конц) = Fe2(SO4)3 +SO2+2H2O Некоторые указали в качестве продукта восстановления серной кислоты серу, но она тут же будет окисляться серной кислотой до сернистого газа. Видео:Окислительно-восстановительные реакции. Семинар 1.Скачать  8) сульфат хрома (III) с бромом в растворе гидроксида калияВидео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  Сульфат хрома (III) – восстановитель, бром –окислитель. Среда щелочная.Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать  Все соединения хрома(III) можно окислить в щелочной среде до хромата, бром восстановится в бромид ион.Видео:Реакции ионного обмена. 9 класс.Скачать  Сr2(SO4)3 +3Br2 +16KOH = 2K2CrO4 +6KBr +3K2SO4+8H2OВ некоторых работах среди продуктов оказались серная и бромоводородная кислоты, они тут же нейтрализуются гидроксидом калия до соответствующих солей. Видео:ЕГЭ. Химия. #Урок8. Окислительно-восстановительные реакции и реакции ионного обмена.Скачать  9) нитрат натрия с раствором гидроксида натрия в присутствии алюминияВидео:8 класс. Составление уравнений химических реакций.Скачать  Нитрат натрия – окислитель, алюминий – восстановитель. Среда щелочная. При взаимодействии алюминия с щелочью выделяется атомарный водород, восстанавливающий нитрат — ион до аммиака:3NaNO3 +5NaOH +8 Al +18H2O = 8Na |
 |
· Приводим подобные члены в суммарном уравнении
и по полученному краткому ионному уравнению дописы-ваем молекулярное уравнение:
· (Пояснить появление K2SO4 в продуктах реакции) Уравнение считается законченным, когда в продуктах реакции и исходных веществах содержится одинаковое число атомов каждого элемента.
Пример 2. Реакция между сульфатом марганца (II) и гипохлоритом калия в щелочной среде:
Уравнение составляем в той же последовательности, которая приведена для реакций в кислой среде.
· Ионная схема реакции:
Mn 2+ + SO4 2– + K + + ClO – + Na + + OH – ® MnO2 + Cl – +.
В исходных реагентах дана щелочь – NaOH, поэтому уравнения полуреакций составляем с учетом щелочной среды: число атомов кислорода и водорода уравниваем гидроксид-ионами ОН — и молекулами воды:
ClO – + H2O ® Cl – + 2OH – .
Чтобы уравнять число атомов кислорода, а затем атомов водорода в щелочной среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать 2n гидроксид-ионов ОН-, а в противоположную часть n молекул воды.
· Уравниваем заряды левой и правой частей уравнений полуреакций:
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
т.е. первая полуреакция — окисление восстановителя, вторая восстановление окислителя.
· Суммируем уравнения полуреакций:
 |
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
 |
Mn 2+ + ClO – + 4OH – + H2O = MnO2 + Cl – + 2H2O + 2OH –
· Приводим подобные члены:
Mn 2+ + ClO – + 2OH – = MnO2 + Cl – + H2O.
Пример 3.Реакция между перманганатом калия и нитритом натрия в нейтральной среде:
Будем придерживаться рекомендованной ранее последо-вательности операций.
· В ионную схему можно не включать молекулы и ионы, не участвующие в полуреакциях:
· При составлении уравнений реакций, протекающих в нейтральной среде, необходимо иметь в виду, что в левой части уравнений полуреакций не должно быть ионов Н + и ОН — , а в правой части эти ионы можно использовать.
Соответствующие уравнения полуреакций:
MnO4 — + 2H2O + 3 
NO2 — + H2O – 2 
Таким образом, в нейтральной среде число атомов кислорода и водорода уравнивают по-разному, в зави-симости от того, в какую часть полуреакции необходимо ввести недостающие атомы. Если в правой части уравнения полуреакции недостаёт n атомов кислорода, в неё следует добавить 2n гидроксид-ионов, а в левую часть – n молекул воды. Если в левой части уравненияполуреакции недостаёт n атомов кислорода, в неё следует добавить n молекул воды, а в правую часть – 2n ионов водорода.
· Суммируем уравнения полуреакций:


NO2 — + H2O – 2 
 |
 |  |
· После объединения ионов OH — и H + в молекулы воды приводим подобные члены и получаем ионное уравнение реакции:
Представим схематически уравнивание числа атомов кислорода и водорода в различных средах, (обозначаем 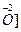
кислая среда — 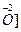
Н2О = 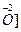
щелочная среда — 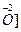
2ОН — = 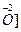
нейтральная среда 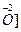
Н2О = 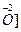
Очевидно, что для уравнивания числа атомов кислорода существует всего два отличающихся приёма: добавление в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, 2n гидроксид-ионов (если это позволяет данная среда), или n молекул воды.
Дата добавления: 2015-08-08 ; просмотров: 5795 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ


 +3NH3
+3NH3