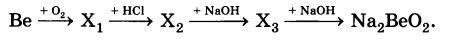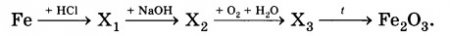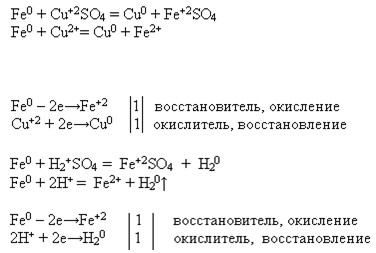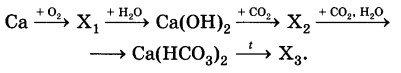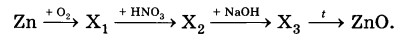- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Составьте уравнения реакций в соответствии со схемой превращений caco3 t x1 c
- Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Основные разделы
- Контрольные работы
- Ответы на контрольную работу по теме «Металлы»(Габриелян)
- 📹 Видео
Видео:Архитектура ПК: Представление вещественных чисел в памяти ПК. Центр онлайн-обучения «Фоксфорд»Скачать

We are checking your browser. gomolog.ru
Видео:#35. Строки. Способы объявления, escape-последовательности | Язык C для начинающихСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:25. Схема реакции и химическое уравнениеСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 701f3a84693a4bfa • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:#11. Арифметические операции деления по модулю, инкремента и декремента | Язык C для начинающихСкачать

Составьте уравнения реакций в соответствии со схемой превращений caco3 t x1 c
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Как классифицируют простые вещества? Как классифицируют сложные вещества? Назовите признаки генетического ряда.
Простые вещества классифицируют: на металлы, неметаллы и благородные газы.
Сложные вещества классифицируют: на неорганические (соли, гидроксиды, бинарные соединения) и органические.
Признаки генетического ряда:
― все вещества одного ряда должны быть образованы одним химическим элементом;
― вешества, образованные одним и тем же элемнтом, должны принадлежать к различным классам химических веществ;
― вещества, образующие генетический ряд элемента, должны быть связаны между собой взаимопревращениями.
Задание 5
Найдите массу осадка, который выпадает при сливании 807 г 20%-ного раствора нитрата свинца (II) с раствором, содержащим избыток иодида калия.
Дано: m(раствора)=807 г, ω(Pb(NO3)2)=20%
Найти: ω( PbI2 )-?
Решение
1 способ
1. Вычисляем массу растворённого нитрата свинца в 20% растворе.
m ( Pb(NO3)2 )= m (раствора) • ω( Pb(NO3)2 ): 100%=807 г •2 0%: 100%=161,4 г
2. Вычисляем количество вещества нитрата свинца массой 161,4 г по формуле: n=m/M, где M ― молярная масса .
M( Pb(NO3)2 )=331 г/моль
n( Pb(NO3)2 )=m( Pb(NO3)2 )/M( Pb(NO3)2 )=161,4 г : 331 г/моль=0,4876 моль
3. Составим химическое уравнение:
Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3
По уравнению реакции n ( Pb (NO3)2):n (PbI2)=1:1, количества веществ одиноковые, поэтому:
n( PbI2 )=n ( Pb(NO3)2 )=0,4876 моль
4. Вычисляем массу иодида калия количеством вещества 0,4876 моль по формуле: m=n•M.
M( PbI2 )=461 г/моль
m(PbI2)=n(PbI2)•M(PbI2)=0,4876 моль • 461 г/моль=225 г
2 способ
1. Вычисляем массу растворённого нитрата свинца в 20% растворе.
m ( Pb(NO3)2 )= m (раствора) • ω( Pb(NO3)2 ): 100%=807 г •2 0%: 100%=161,4 г
2. Составим химическое уравнение:
161,4 г х г
Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3
331 г 461 г
Над формулами соединений Pb(NO3)2 и PbI2 записываем вычисленную массу нитрата свинца (II) (161,4 г) и неизвестную массу иодида свинца (II) (х г), а под формулами соединений ― массы соответствующих количеств веществ согласно коэффициентам в химическом уравнении.
M( Pb(NO3)2 )=331 г/моль , масса 1 моль=331 г
M( PbI2 )=461 г/моль, м асса 1 моль = 461 г
х=m( PbI2 )=161,4 г • 461 г : 331 г=225 г
Ответ: 225 г осадка иодида свинца (II).
Задание 6
Какие из перечисленных веществ взаимодействуют с соляной кислотой: магний, оксид меди (II), гидроксид меди (II) , медь, нитрат магния, гидроксид железа (III), оксид кремния (IV), нитрат серебра, сульфид железа (II) ?
Запишите уравнения возможных реакций.
Mg + 2HCl = MgCl2 + H2↑
CuO + 2HCl = CuCl2 + H2O
Cu(OH)2↓ + 2HCl = CuCl2 + 2H2O
Fe(OH)3↓ + 3HCl = FeCl3 + 3H2O
AgNO3 + HCl = HNO3 + AgCl↓
FeS ↓ + 2HCl = FeCl2 + H2S↑
Задание 7
Какие из перечисленных веществ взаимодействуют с гидроксидом натрия: оксид углерода (IV) , гидроксид кальция, оксид меди (II), нитрат меди (II) , хлорид аммония, кремниевая кислота , сульфат калия?
Запишите уравнения возможных реакций, назовите продукты реакций.
2NaOH + CO2 = Na2CO3 + H2O
Продукты реакции: карбонат натрия и вода
2NaOH + Cu(NO3)2 = 2NaNO3 + Cu(OH)2↓
Продукты реакции: нитрат натрия игидроксид меди (II)
NaOH + NH4Cl = NaCl + H2O + NH3↑
Продукты реакции: хлорид натрия, вода и аммиак
2NaOH + H2SiO3 ↓ = Na2SiO3 + 2H2O
Продукты реакции: силикат натрия и вода
Задание 8
Предложите свою классификацию химических веществ и генетической связи между классами неорганических соединений.
Представители различных классов неорганических соединений одного и того же химического элемента.
Генетический ряд металлов: Ca ⟶ CaO ⟶ Ca(OH)2 ⟶ СaCO3 ⟶ CaO
Генетический ряд неметаллов: S ⟶ SO2 ⟶ SO3 ⟶ H2SO4 ⟶ Na2SO 4
Видео:#33. Операции с массивами копирование, вставка, удаление и сортировка | Язык C для начинающихСкачать

Ответы на контрольную работу по теме «Металлы»(Габриелян)
Видео:Стек на языке CСкачать

Основные разделы
Видео:Схемы сертификации и декларирования ЕАЭС. В чем отличие?Скачать

Контрольные работы
Видео:1 1 127 Составить алгоритм решения ребуса 4ABC + CBA = ABCBСкачать

Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Post category:Контрольные работы по химии 9 класс
- Reading time: 12 минут чтения
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n (Mg) = 12/24 = 0,5 моль
V (H2) = 10/22,4 = 0,446 моль
n (Mg) = n (H2) по уравнению (теор.)
выход = 0,446 /0,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2H2O = 2LiOH + H2
2Li + 2HCl = 2LiCl + H2
Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O
2H+ + Ca(OH)2 =Ca2+ +2H2O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
Al3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-
Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
V (H2) = 8,96/22,4 = 0,4 моль
n (Na) : n (H2) = 2:1
n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2H2O = 2KOH + H2.
2К + CI2 = 2КCI
2К + 2HCI = 2КCI + H2
Mg + 2HCl = MgCl2 + H2
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2H2O=Mg(OH)2+H2
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (H2) = 30/22,4 = 1,34 моль
n (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (H2) = n (Mg) по уравнению (теор.)
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + H2SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+H2SO4 —>ZnSO4 + H2O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + H2
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
2n (H2) = n (Na) по уравнению (теор.)
n (H2) = 0,5 моль теор.
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
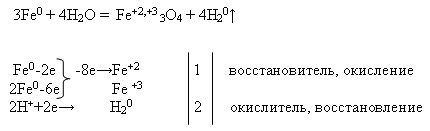
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (H2) = n (Ca) по уравнению (теор.)
n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2
Mg + 2H+ = Mg2+ + H2
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= H2 окислитель
Mg + Cl2 = MgCl2
Mg+2H2O=Mg(OH)2+H2
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ H2O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + H2O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (H2) (теор.) = n(Mg) =0,475 моль
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2H2O = 2LiOH + H2
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + H2
Ва + 2H+ = Ва 2+ + H2
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= H2 окислитель
Ва + Cl2 = ВаCl2
Ва +2H2O= Ва(OH)2+H2
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + H2↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2
Са0 + 2H+ = Са 2+ + H2
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= H2 окислитель
Са + Cl2 = СаCl2
Са +2H2O= Са(OH)2+H2
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
3. 2Zn + O2 = 2ZnO
Zn + H2O = ZnO + H2
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= H2 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaО+H2O=Ca(OH)2
Ca(OH)2+H2CO3=CaCO3+2H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (H2) (теор.) = 0,5 n(Mg) =0,5 моль
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2H2О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (H2) (теор.) = n(Ca) =1,47 моль
n (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
📹 Видео
ЕГЭ Информатика 2020 ФИПИ Задача 13 (байт на хранение доп. сведений)Скачать

Химия 9 класс (Урок№6 - Реакции ионного обмена и условия их протекания.)Скачать

#55. Реализация стека (пример использования структур) | Язык C для начинающихСкачать

Регистрация декларации о соответствии ТР ТС своими рукамиСкачать

15 минут занятия 5 Пишем жалобу в КС: этап 2 Курс "Защита в Конституционном Суде”/Полное👇Скачать

Почему в Excel отображается ссылка вместо значенияСкачать

Формирование КС-2 и КС-3 в ПК "Smeta.ru"Скачать
Реализация стека на Си за 90 секундСкачать

Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

C# КЛАСС CONVERT | КОНВЕРТАЦИЯ СТРОК В ЛЮБОЙ ТИП ДАННЫХ 😱Скачать

wb002 Элементы стека протоколов TCP/IPСкачать