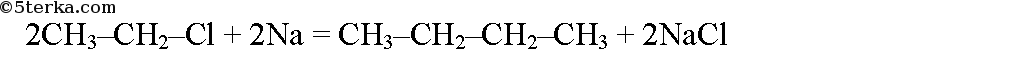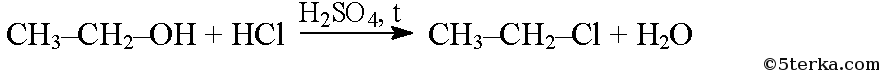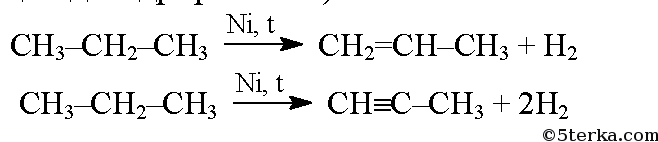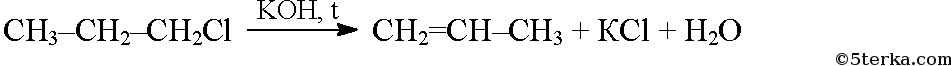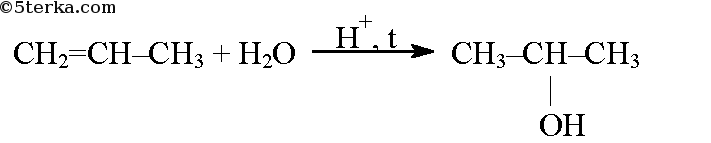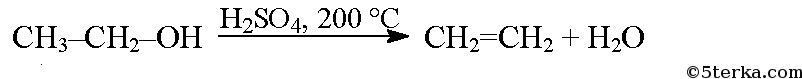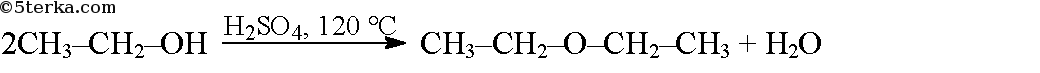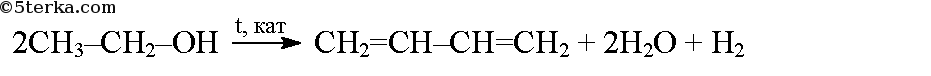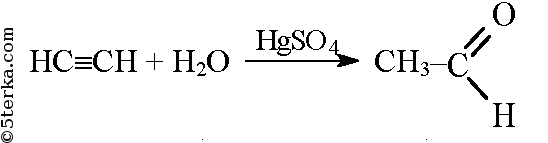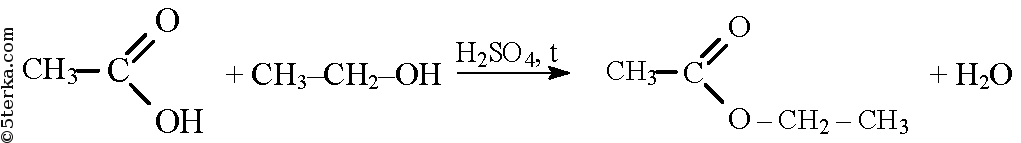Галогенопроизводные углеводородов реагируют с натрием, при этом образуются предельные углеводороды, содержащие в молекуле вдвое больше атомов углерода, чем исходное галогенопроизводное (реакция Вюрца):
При действии на галогенопроизводные углеводородов водного раствора щелочи образуются спирты:
При взаимодействии спиртов с галогеноводородами в присутствии концентрированной серной кислоты образуются галогенопроизводные углеводородов:
При отщеплении водорода от предельных углеводородов могут образоваться углеводороды ряда этилена — алкены или углеводороды ряда ацетилена — алкины (реакция дегидрирования):
При присоединении водорода к алкенам и алкинам образуются предельные углеводороды (реакция гидрирования):
Под действием спиртового раствора щелочи от галогенопроизводных отщепляется галогеноводород, при этом образуются алкены:
При присоединении к алкенам воды образуются спирты, реакция также протекает по правилу Марковникова.
При сильном нагревании спиртов с серной кислотой происходит дегидратация и образуются алкены:
При более слабом нагревании в результате дегидратации образуются простые эфиры:
Можно осуществить одновременно дегидрирование и дегидратацию спиртов, при этом образуются диеновые углеводороды:
Спирты можно окислить в альдегиды:
Можно, наоборот, восстановить альдегиды в спирты:
В результате присоединения к ацетилену воды образуется уксусный альдегид (реакция Кучерова).
При окислении альдегидов образуются карбоновые кислоты:
Получение альдегидов из предельных углеводородов:
При взаимодействии спиртов и карбоновых кислот в присутствии катализатора, например серной кислоты, образуются сложные эфиры.
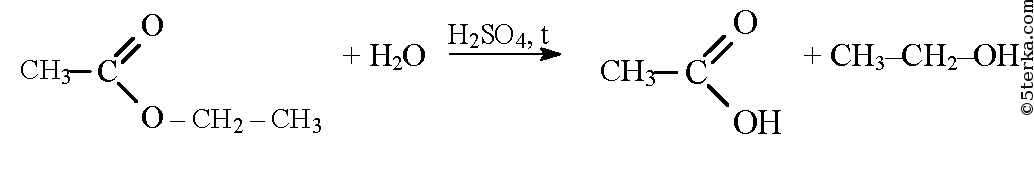
Если нагреть смесь сложного эфира и воды в присутствии серной кислоты, то протекает обратная реакция — гидролиз сложного эфира — и образуются спирт и карбоновая кислота.

задача №17
к главе «Глава VII. Спирты и фенолы. §1 (стр. 85) Вопросы».
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

Запишите уравнения реакций согласно схеме. Составьте уравнения реакций в молекулярной и ионной формах. NaOH – NaCl – NaHSO4 —
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Ваш ответ
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

решение вопроса
Видео:8 класс. Составление уравнений химических реакций.Скачать

Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Составьте схему «Получение солей» и проиллюстрируйте ее уравнениями химических реакций. Обсудите итог работы с соседом по парте.
Вариант 1.
- Из металлов.
Металл + неметалл: 2Fe + 3Cl2 = 2FeCl3.
Металл + соль (металл в виде простого вещества должен стоять левее в ряду Бекетова, чем тот металл, который входит в состав соли): Mg + FeSO4 = MgSO4 + Fe.
Металл + кислота (металл должен стоять левее водорода в ряду Бекетова): Zn + 2HCl = ZnCl2 + H2. - Из оксидов.
Основный оксид + кислотный оксид: CaO + SO3 = CaSO4.
Основный или амфотерный оксид + кислота: ZnO + H2SO4 = ZnSO4 + H2O.
Основный оксид + амфотерный оксид (сплавление): ZnO + Na2O = Na2ZnO2 – цинкат натрия.
Амфотерный оксид + щелочь: ZnO + 2NaOH + H2O = Na2[Zn(OH)4] – тетрагидроксоцинкат натрия. - Из гидроксидов.
Щелочь + кислотный оксид: NaOH + CO2 = NaHCO3.
Основание + кислота: NaOH + HCl = NaCl + H2O.
Основание + соль (реакция идет если один продуктов реакции малорастворим или неустойчив): 2NaOH + FeCl2 = 2NaCl + Fe(OH)2↓. - Из кислот.
Кислота + металл (металл должен стоять левее водорода в ряду Бекетова): Fe + 2HCl = FeCl2 + H2.
Кислота + основный оксид: H2SO4 + MgO = MgSO4 + H2O.
Кислота + основание: KOH + HNO3 = KNO3 + H2O.
Кислота + соль (реакция идет если один продуктов реакции малорастворим или неустойчив, а также если образующаяся кислота намного слабее той, которая вступает в реакцию): CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ - Из солей.
Соль + металл (металл в виде простого вещества должен стоять левее в ряду Бекетова, чем тот металл, который входит в состав соли): Mg + ZnSO4 = MgSO4 + Zn.
Соль + основание (реакция идет если один продуктов реакции малорастворим или неустойчив): 2NaOH + Fe(NO3)2 = 2NaNO3 + Fe(OH)2↓.
Соль + кислота (реакция идет если один продуктов реакции малорастворим или неустойчив, а также если образующаяся кислота намного слабее той, которая вступает в реакцию): BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
Соль + соль (реакция идет если один продуктов реакции малорастворим или неустойчив): AgNO3 + NaCl = NaNO3 + AgCl↓.
Вариант 2.
Примечания:
1 – металл должен находится левее водорода в ряду Бекетова
2 – в результате реакции должен выпадать осадок или выделяться газ (нерастворимая соль или неустойчивая, летучая кислота)
3 – хотя бы один из продуктов реакции должен быть нерастворим
4 – металл должен стоять в ряду Бекетова левее, чем металл, входящий в состав соли
5 – хотя бы одна из солей должна быть нерастворима
Вариант 3.
Вот схема попроще:
🎬 Видео
Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений реакций (по валентности). 8 класс.Скачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Составление уравнений реакций. 1 часть. 8 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать