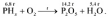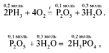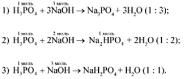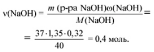тест по химии
Видео:8 класс. Составление уравнений химических реакций.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| test_fosfor_i_ego_soedineniya_9_klass.docx | 18.56 КБ |
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Предварительный просмотр:
Дата _______________________ ФИО ___________________________
Тест по теме «Фосфор и его соединения»
1. Число нейтронов в ядре атома фосфора 31 Р равно 1) 15; 2) 16; 3) 31; 4) 46
2. Исключите «лишний» элемент из перечисленных по принципу возможности образования аллотропных модификаций:
а) кислород; б) азот; в) фосфор; г) сера.
3. Сумма коэффициентов в уравнении электролитической диссоциации фосфата калия равна:
а) 5; б) 3; в) 4; г) 8.
4. Ортофосфорная кислота может реагировать со следующими веществами:
а) оксид меди(II); б) гидроксид калия;
в) азотная кислота; г) цинк.
5. Укажите, какое суждение является правильным:
А) кристаллическая решетка белого фосфора построена из молекул Р 4 ;
Б) кристаллическая решетка белого фосфора построена из атомов фосфора.
1) верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны
6. Определите вещества Х и Y в схеме превращений:
P → X → PH 3 → Y → H 3 PO 4
1) Mg 3 P 2 и P 2 O 5 ; 2) Ca 3 P 2 и P 2 O 3;
3) H 3 PO 4 и P 2 O 5 ; 4) P 2 O 5 и P 2 O 3
7. В ходе реакции по схеме CaCI 2 + Na 3 PO 4 → Ca 3 (PO 4 ) 2 + NaCI взаимодействуют следующие ионы
1) Na + и CI − ; 2) Ca 2+ и CI − ;
3) Ca 2+ и PO 3- 4 ; 4) Na + и PO 3- 4
8. Важнейший компонент природных минералов фосфора
1) Ca 3 P 2 ; 2) Na 3 PO 4 ;
3) P 2 O 3 ; 4) Ca 3 (PO 4 ) 2
9. Установите соответствие между названием соли и ее формулой. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
НАЗВАНИЕ СОЛИ ФОРМУЛА СОЛИ
А) фосфат кальция 1) Ca(H 2 PO 4 ) 2
Б) фосфид кальция 2) Ca HPO 4
В) дигидрофосфат 3) Ca 3 P 2
кальция 4) KH 2 PO 4
Г) гидрофосфат 5) Ca 3 (PO 4 ) 2
Д) дигидрофосфат калия
10. Осуществите превращение согласно схеме:
P → P 2 O 5 → Mg 3 (P O 4 ) 2 → Mg CI 2 → Mg (OH) 2
Дата _______________________ ФИО ___________________________
Тест по теме «Фосфор и его соединения»
1. Число электронов на внешнем уровне атома фосфора:
а) 2; б) 3; в) 5; г) 15.
2. Сумма коэффициентов в реакции между фосфором и кальцием равна:
а) 5 ; б) 6; в) 3 ; г) такая реакция невозможна.
3. Укажите, какое суждение является правильным:
А) атом фосфора имеет три электронных уровня;
Б) на внешнем уровне атома фосфора имеется пять электронов.
1) верно только А ; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны
4 . Укажите реактив, с помощью которого можно обнаружить присутствие растворимых фосфатов в растворе:
1) AgNO 3 ; 2) BaCI 2 ; 3) NaOH; 4) HCI
5. Составьте уравнение реакции по схеме
Р+ HNO 3 → H 3 PO 4 +NO 2 +H 2 O. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
1) 9; 2) 13 ; 3) 10; 4) 14
6. Химическая реакция Ag 3 PO 4 + 3HNO 3 = 3AgNO 3 + H 3 PO 4 идет потому, что образуется:
1) осадок; 2) газ ; 3) вода;
4) данная реакция не протекает
7. Укажите, какое суждение является правильным:
А) гигроскопичный порошок ⎯ это порошок, поглощающий пары воды;
Б) оксид фосфора (V) можно использовать для осушения хлороводорода.
1) верно только А ; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны
8. В ходе реакции по схеме MgCI 2 + K 3 PO 4 → Mg 3 (PO 4 ) 2 + KCI взаимодействуют следующие ионы
1) K + и PO 3- 4 ; 2) Mg 2+ и CI − ;
3) Mg 2+ и PO 3- 4 ; 4) K + и CI −
9. Установите соответствие между схемой превращений и веществом Х в этой схеме. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
СХЕМА ПРЕВРАЩЕНИЙ ВЕЩЕСТВО Х
А) Р → Х → H 3 PO 4 1) PH 3
Б) Р → Х → PH 3 2) P 4
В) Ca 3 P 2 → X → P 2 O 5 3) P 2 O 5
Г) Ca 3 (PO 4 ) 2 → X → P 2 O 5 4) H 3 PO 4
Видео:32 задание. Соединения фосфораСкачать

Проверочная работа по теме «Фосфор и его соединения»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
311 лекций для учителей,
воспитателей и психологов
Получите свидетельство
о просмотре прямо сейчас!
Проверочная работа по теме «Фосфор и его соединения» 9 класс
Тесты. К каждому заданию дается 4 варианта ответов, из которых только один правильный
1. Распределение электронов по энергетическим уровням в атоме фосфора
А) 2,8,3 В) 2,5 С) 2,8,5 D ) 2,8,8,5
2. О ксид фосфора (V) не взаимодействует с
A ) нитратом серебра B ) водой C ) гидроксидом кальция D ) оксидом кальция
3. Сумма коэффициентов в уравнении взаимодействия магния с фосфором: A ) 5 B ) 7 C ) 6 D ) 8
4. Фосфор является восстановителем при взаимодействии с
А) магнием В) водородом С) хлором D ) натрием
5. Массовая доля кислорода (%) в ортофосфорной кислоте A ) 3,1 B ) 31,5 C )16,3 D ) 65,3
Упражнения. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: P 


Диктант. 1. Что такое фосфин? 2. Дайте названия соединениям Са 3 Р 2 , Са(Н 2 РО 4 ) 2 , Са 3 (РО 4 ) 2 .
Задача. При сжигании в кислороде 62 г фосфора было получено 130 г оксида фосфора (V). Вычислите массовую долю выхода оксида фосфора (V) в % от теоретически возможного.
Тесты. К каждому заданию дается 4 варианта ответов, из которых только один правильный
1. Число электронов на внешнем уровне атома фосфора A ) 15 B ) 2 C ) 3 D ) 5
2. О ксид фосфора (V) взаимодействует с
A ) оксидом серы (VI) B ) кислородом C ) оксидом натрия D ) азотной кислотой
3. Сумма коэффициентов в уравнении взаимодействия магния с фосфором A ) 5 B ) 6 C ) 10 D ) 8
4. Чему равна валентность и степень окисления фосфора в Н 3 РО 4 А) III и +3 В) V и +5 С) III и +5 D ) V и +3
5. Массовая доля кислорода (%) в оксиде фосфора ( V ) A ) 56,3 B ) 43,7 C ) 11,3 D ) 21,8
Упражнения. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: H 3 PO 4 


Диктант. 1. Название водородного соединения фосфора. 2. Запишите формулы фосфата кальция, фосфида кальция, дигидрофосфата кальция.
Задача. Какая масса фосфата кальция нужна для получения 62 кг фосфора при выходе реакции 80%?
Тесты. К каждому заданию дается 4 варианта ответов, из которых только один правильный
1. Электронная формула атома фосфора A) 1s 2 2s 2 2p 6 3s 2 2p 3 B) 1s 2 2s 2 2p 3 C) 1s 2 2s 2 2p 6 3s 2 3p 3 D) 1s 2 2s 2 2p 6
2. . Фосфорная кислота взаимодействует с:
A ) нитратом серебра B ) хлоридом цинка C ) нитратом калия D ) оксидом кальция
3. Сумма коэффициентов в уравнении взаимодействия натрия с фосфором: A ) 5 B ) 7 C ) 6 D ) 8
4. Максимальную степень окисления фосфор проявляет в составе:
А) фосфида натрия В) фосфорной кислоты С) фосфида кальция Д) фосфина (РН 3 )
5. Массовая доля кислорода (в %) в фосфате калия A ) 55,2 B ) 37 C ) 30,2 D ) 14,6
Упражнения. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: P 


Диктант. 1. Что такое белый фосфор, красный фосфор? 2. Как называются соли фосфорной кислоты?
Задача. Какую массу фосфора можно получить из 310 г фосфата, при выходе реакции 75%?
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Тренажер задания 32 по химии фосфора
- Ортофосфат кальция прокалили с углем и речным песком. Образовавшееся при этом белое светящееся в темноте вещество сожгли в атмосфере хлора. Продукт этой реакции растворили в избытке гидроксида калия. К полученной смеси прилили раствор гидроксида бария. Напишите уравнения описанных реакций.
- Простое вещество, полученное при нагревании смеси фосфата кальция с коксом и оксидом кремния, растворяется в растворе едкого кали. Выделяющееся газообразное вещество сожгли, продукты горения собрали и охладили, а в полученный раствор добавили нитрат серебра. Напишите уравнения описанных реакций.
- Смесь ортофосфата кальция, кокса и песка нагрели в электрической печи. Один из продуктов этой реакции может самовоспламеняться на воздухе. Твердый продукт горения этого вещества при нагревании растворили в воде и через полученный раствор пропустили газообразный аммиак. Напишите уравнения описанных реакций.
- Простое вещество, смесь которого с бертолетовой солью используется в спичках и воспламеняется при трении, сожгли в избытке кислорода. Твердое вещество белого цвета, образовавшееся в результате сгорания, растворили в избытке раствора гидроксида натрия. Полученная при этом соль с раствором нитрата серебра образует осадок ярко-желтого цвета. Напишите уравнения описанных реакций.
- Белый фосфор растворяется в растворе едкого кали с выделением газа с чесночным запахом, который самовоспламеняется на воздухе. Твердый продукт реакции горения прореагировал с едким натром в таком соотношении, что в образовавшемся веществе белого цвета содержится один атом водорода, при прокаливании последнего вещества образуется пирофосфат натрия. Напишите уравнения описанных реакций.
- Фосфор сожгли в избытке хлора, образующееся твердое вещество смешали с фосфором и нагрели. Продукт реакции обработали водой, при этом выделился бесцветный газ с резким запахом. Раствор добавили к подкисленному серной кислотой раствору перманганата калия, который в результате реакции обесцветился. Напишите уравнения описанных реакций.
или, так как ортофосфат марганца нерастворим
- Продукт взаимодействия фосфида магния с водой сожгли и продукты реакции поглотили водой. Образовавшееся вещество используется в промышленности для получения двойного суперфосфата из фосфорита. Напишите уравнения описанных реакций.
- Фосфин пропустили через горячий раствор концентрированной азотной кислоты. раствор нейтрализовали негашеной известью, выпавший осадок отделили, смешали с коксом и кремнезёмом и прокалили. Продукт реакции, который светится на воздухе, нагрели в растворе едкого натра. Напишите уравнения описанных реакций.
- Красный фосфор сожгли в атмосфере хлора. Продукт реакции обработали избытком воды и в раствор добавили порошкообразный цинк. Выделившийся газ пропустили над нагретым оксидом двухвалентного железа. Напишите уравнения описанных реакций.
- Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт реакции при нагревании растворили в большом количестве воды. После нейтрализации полученного раствора пищевой содой в него добавили нитрат серебра. Напишите уравнения описанных реакций.
- К твёрдому веществу, которое образуется при сжигании фосфора в избытке хлора, добавили фосфор и смесь нагрели. Продукт реакции обработали небольшим количеством горячей воды и в полученный раствор добавили подкисленный серной кислотой раствор перманганата калия. Напишите уравнения описанных реакций.
- Твердое вещество, которое образуется при нагревании фосфора и пятихлористого фосфора, растворили в большом количестве воды. Часть полученного раствора добавили в подкисленный серной кислотой раствор перманганата калия, при этом последний обесцветился. Напишите уравнения описанных реакций.
- Фосфат кальция прокалили с углем в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
- Фосфат кальция прокалили с песком и углем. Полученное простое вещество сожгли в кислороде, продукт реакции растворили в воде и нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
- Фосфор сожгли в избытке кислорода, а образовавшееся вещество сплавили с оксидом натрия. полученную соль разделили на две части: первую ввели в реакцию с хлоридом кальция, а вторую – с нитратом серебра. Напишите уравнения описанных реакций.
- Красный фосфор окислили кипящей азотной кислотой. Выделившийся при этом газ поглотили раствором гидроксида калия. Продукт окисления в первой реакции нейтрализовали гидроксидом натрия, а к образовавшейся реакционной массе по каплям добавили раствор хлорида кальция до прекращения выпадения осадка. Напишите уравнения описанных реакций.
Видео:Cистемы уравнений. Разбор задания 6 и 21 из ОГЭ. | МатематикаСкачать

Тест по теме «Фосфор и его соединения»
Тема «Фосфор и его соединения» является одной из важных тем главы «Неметаллы» курса химии 9 класса. Решение задач и тестовых заданий по этой закрепляет полученные знания.
Просмотр содержимого документа
«Тест по теме «Фосфор и его соединения»»
Тест по теме «Фосфор и его соединения»
1. Исключите «лишний» элемент из перечисленных по принципу возможности образования аллотропных модификаций:
а) кислород; б) азот;
в) фосфор; г) сера.
2. При взаимодействии 42,6 г фосфорного ангидрида и 400 г 15%-го раствора гидроксида натрия образуется:
а) фосфат натрия;
б) гидрофосфат натрия;
в) смесь фосфата и гидрофосфата натрия;
г) смесь гидро- и дигидрофосфата натрия.
3. Сумма коэффициентов в уравнении электролитической диссоциации фосфата калия равна:
а) 5; б) 3; в) 4; г) 8.
4. Число электронов на внешнем уровне атома фосфора:
а) 2; б) 3; в) 5; г) 15.
5. Фосфор, полученный из 33 г технического фосфата кальция, сожгли в кислороде. Образовавшийся оксид фосфора(V) прореагировал с 200 мл 10%-го раствора гидроксида натрия (плотность – 1,2 г/мл) с образованием средней соли. Масса примесей в техническом образце фосфата кальция (в г) составляет:
а) 3,5; б) 1,5; в) 2; г) 4,8.
6. Число 
а) 2; б) 12; в) 14; г) 10.
7. Число атомов водорода, содержащихся в 4,48 л (н.у.) фосфина равно:
а) 1,2•10 23 ; б) 0,6•10 23 ;
в) 6,02•10 23 ; г) 3,6•10 23 .
8. При температуре 30 °С некая реакция протекает за 15 с, а при 0 °С – за 2 мин. Коэффициент Вант-Гоффа для данной реакции:
а) 2,4; б) 2; в) 1,8; г) 3.
9. Ортофосфорная кислота может реагировать со следующими веществами:
а) оксид меди(II); б)гидроксид калия;
в) азотная кислота; г) цинк.
10. Сумма коэффициентов в реакции между фосфором и бертолетовой солью равна:
а) 9; б) 6; в) 19; г) такая реакция невозможна.
— See more at: http://izolushka.ru/?p=509#sthash.DKfn94gz.dpuf
Задачи и упражнения на фосфор и его соединения
Ц е п о ч к и п р е в р а щ е н и й:
1. Фосфор — пентаоксид фосфора — ортофосфорная кислота — фосфат кальция ® фосфорная кислота.
2. Фосфат кальция — фосфор — фосфид кальция — фосфин — пентаоксид фосфора — фосфорная кислота — дигидрофосфат кальция.
3. Фосфат кальция — А — В — С — Д — Е — фосфат кальция. Все вещества содержат фосфор, в схеме три ОВР подряд.
4. Фосфор — пентаоксид фосфора — фосфат кальция — фосфор — фосфин — фосфорная кислота — дигидрофосфат кальция.
5. Фосфид кальция (+ р-р соляной кислоты) — А (+ кислород) — В (+ гидроксид натрия, недостаток) — С (+ гидроксид натрия, избыток) — Д (+ гидроксид кальция) — Е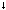
У р о в е н ь А
1. При полном сгорании 6,8 г вещества получили 14,2 г пентаоксида фосфора и 5,4 г воды. К полученным продуктам реакции добавили 37 мл 32%-го раствора едкого натра (плотность 1,35 г/мл). Установите формулу исходного вещества и определите концентрацию полученного раствора.







Следовательно, формула исходного вещества – PH3, а уравнение реакции:
тогда фосфорной кислоты образуется:


Со щелочью фосфорная кислота может реагировать следующим образом:
Определим по условию задачи количество вещества NaOH:


следовательно, идет реакция 2.


m(Na2HPO4) = M(Na2HPO4)•

Ответ. PH3; 
2. При полном электролизе 1 кг раствора сульфата железа(II) на катоде выделилось 56 г металла. Какая масса фосфора может вступить в реакцию с веществом, выделившимся на аноде, и каков будет состав соли, если полученный продукт реакции растворить в 87,24 мл 28%-го раствора гидроксида натрия (плотность раствора 1,31 г/мл)?
Ответ. 12,4 г фосфора; гидрофосфат натрия.
3. 20 г смеси, состоящей из сульфата бария, фосфата кальция, карбоната кальция и фосфата натрия, растворили в воде. Масса нерастворившейся части составила 18 г. При действии на нее соляной кислоты выделилось 2,24 л газа (н.у.) и масса нерастворимого остатка составила 3 г. Определите состав исходной смеси солей по массе.
4. Сколько кг фосфора может быть получено из 1 т фосфорита, содержащего 40 % примесей? Какой объем при н.у. займет фосфин, полученный из этого фосфора?
Ответ. 120 кг P; 86,7 м 3 PH3.
5. 40 г минерала, содержащего 77,5 % фосфата кальция, смешали с избытком песка и угля и нагрели без доступа воздуха в электрической печи. Полученное простое вещество растворили в 140 г 90%-й азотной кислоты. Определите массу гидроксида натрия, который потребуется для полной нейтрализации продукта окисления простого вещества.
Ответ. 24 г NaOH.
У р о в е н ь Б
1. Для полной нейтрализации раствора, полученного при гидролизе 1,23 г некоторого галогенида фосфора, потребовалось 35 мл 2М раствора гидроксида калия. Определите формулу галогенида.
Ответ. Трифторид фосфора.
2. Пробу безводного этанола, содержащего в качестве примеси 0,5 % оксида фосфора(V), сожгли в достаточном количестве кислорода. Образовавшиеся газы отделили, а полученный раствор нагрели до прекращения выделения газа, после чего к нему добавили равный по массе 0,5%-й раствор гидроксида калия. Определите массовые доли веществ в полученном растворе.
3. К 2 г смеси гидрофосфата и дигидрофосфата калия, в которой массовая доля фосфора равна 20 %, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли веществ в полученном растворе.
4. При обработке водой смеси гидрида и фосфида щелочного металла с равными массовыми долями образовалась газовая смесь с плотностью по азоту 0,2926. Установите, какой металл входил в состав соединений.
5. 50 г смеси фосфата кальция и карбонатов кальция и аммония прокалили, в результате получили 25,2 г твердого остатка, к которому добавили воду, а затем пропустили избыток углекислого газа. Масса нерастворившегося остатка составила 14 г. Определите массу карбоната аммония в исходной смеси.
При прокаливании смеси идут следующие процессы:
1) Ca3(PO4)2 
2)
3) (NH4)2CO3 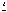
После добавления воды:
После пропускания углекислого газа:
Находим массу CaO:
m(CaO) = 25,2 – 14 = 11,2 г.



К а ч е с т в е н н ы е з а д а ч и
1. Твердое, белое, хорошо растворимое в воде соединение А представляет собой кислоту. При добавлении к водному раствору А оксида В образуется белое нерастворимое в воде соединение С. В результате прокаливания при высокой температуре вещества С в присутствии песка и угля образуется простое вещество, входящее в состав А. Идентифицируйте вещества, напишите уравнения реакций.
2. Смесь двух твердых веществ красного цвета (А) и белого цвета (В) воспламеняется при слабом трении. В результате реакции образуются два твердых вещества белого цвета, одно из которых (С) растворяется в воде с образованием кислого раствора. Если к веществу С добавить оксид кальция, образуется белое нерастворимое в воде соединение. Идентифицируйте вещества, напишите уравнения реакций.
3. Нерастворимое в воде соединение А белого цвета в результате прокаливания при высокой температуре с углем и песком в отсутствии кислорода образует простое вещество В, существующее в нескольких аллотропных модификациях. При сгорании вещества В образуется соединение С, растворяющееся в воде с образованием кислоты Е, способной образовывать три типа солей. Идентифицируйте вещества, напишите уравнения реакций.
* Знак +/– означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
** Интересной является окислительно-восстановительная реакция (ОВР), протекающая при зажигании спичек:
🔍 Видео
Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Составление формул соединений. 8 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Почему лист А4 именно такого размера? ФИЗИКА ЗА МИНУТУ #1Скачать

Решение цепочек превращений по химииСкачать

Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Как составлять окислительно-восстановительные реакции? | ЕГЭ ХИМИЯ 2022 | СОТКАСкачать

Решение заданий ЕГЭ по химии с развернутым ответомСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Тесты по химии. Ионные уравнения. А19 ЦТ 2008 по химииСкачать

Составляем уравнение прямой по точкамСкачать

Задачи по химии. Использование системы уравнений 4Скачать