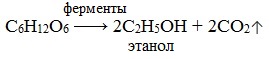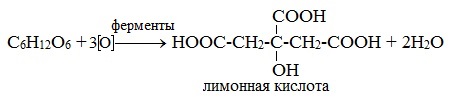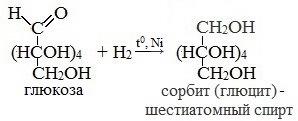Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
- Специфические свойства
- Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
- Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
- Реакции с участием полуацетального гидроксила
- Реакции окисления
- 3. Напишите уравнения реакций окисления и восстановления глюкозы. Назовите полученные вещества. Наличие какой функциональной группы в молекуле глюкозы даёт возможность провести эти реакции?
- 3. Напишите уравнения реакций окисления и восстановления глюкозы. Назовите полученные вещества. Наличие какой функциональной группы в молекуле глюкозы даёт возможность провести эти реакции?
- Составьте уравнения реакций окисления и восстановления глюкозы
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Химические свойства глюкозы. Получение, применение
- 🎦 Видео
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
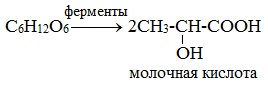
2) Молочнокислое брожение
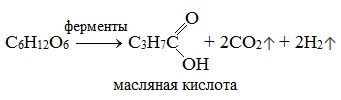
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
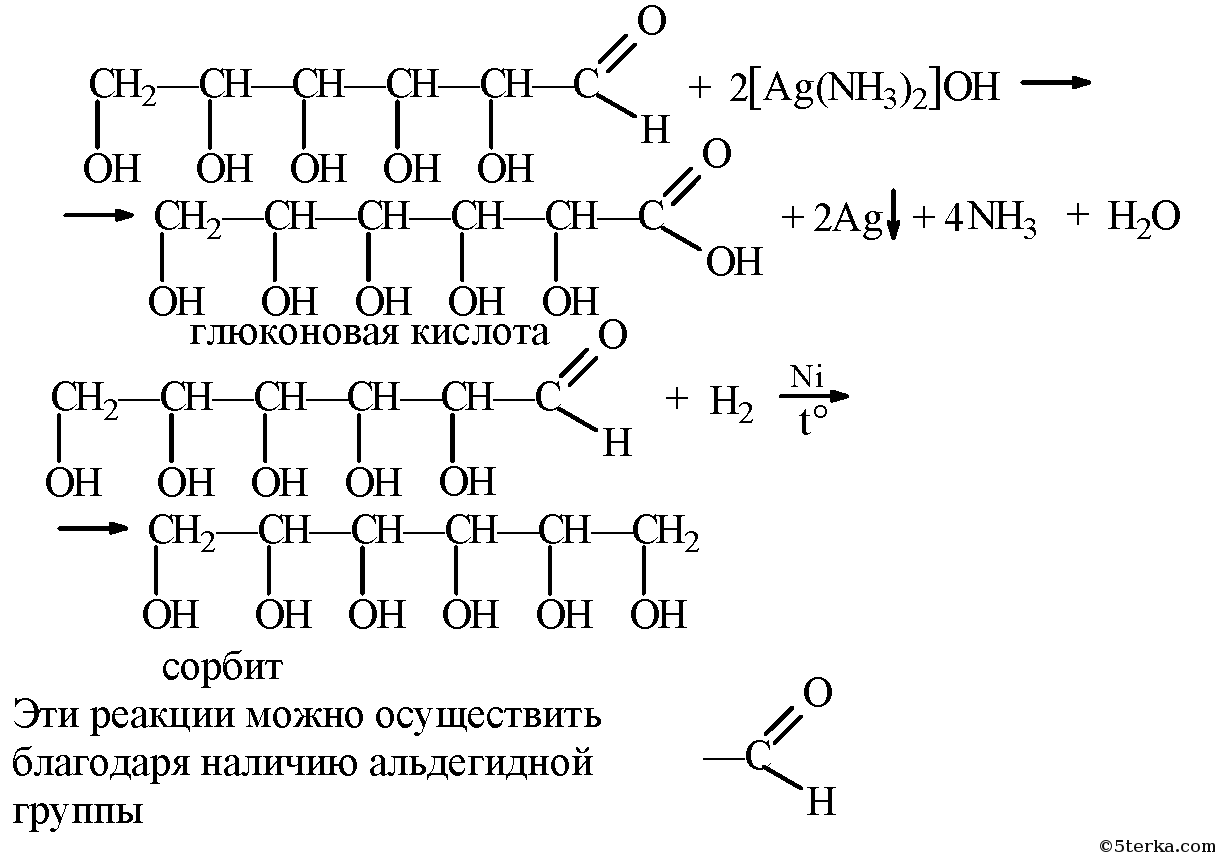
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
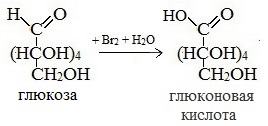
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
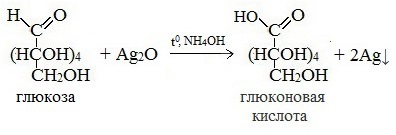
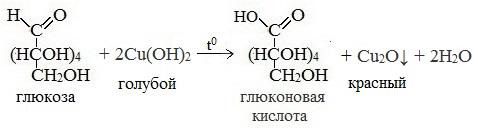
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
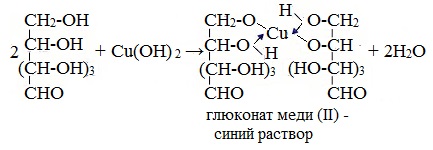
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
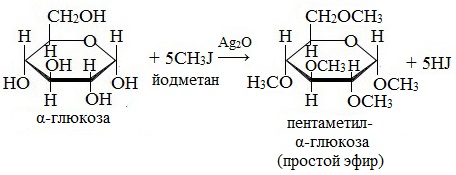
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
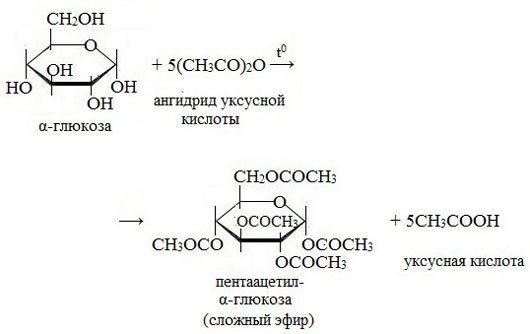
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
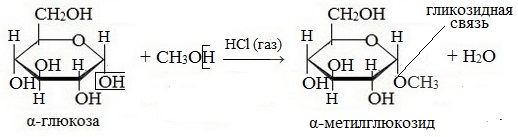
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
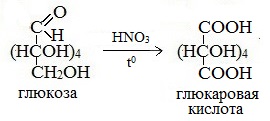
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

3. Напишите уравнения реакций окисления и восстановления глюкозы. Назовите полученные вещества. Наличие какой функциональной группы в молекуле глюкозы даёт возможность провести эти реакции?
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

3. Напишите уравнения реакций окисления и восстановления глюкозы. Назовите полученные вещества. Наличие какой функциональной группы в молекуле глюкозы даёт возможность провести эти реакции?

задача №3
к главе «Тема IX. Углеводы. Работа 5. Итоговая по темам VII, VIII (VIII, IX). Вариант 4».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Составьте уравнения реакций окисления и восстановления глюкозы
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Видео:Свойства глюкозы. 11 класс.Скачать
Химические свойства глюкозы. Получение, применение
I. Получение глюкозы
1. В промышленности
2. В лаборатории
- Из формальдегида (1861 г А.М. Бутлеров):
3. В природе
4. Другие способы
сахароза глюкоза фруктоза
II. Химические свойства глюкозы
1. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
2. Молочнокислое брожение:
3. Маслянокислое брожение:
2. Свойства альдегидов
1. Реакция серебряного зеркала:
2. Окисление гидроксидом меди (II):
3. Восстановление:
сорбит – шестиатомный спирт
3. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
4. Реакции окисления
III. Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
🎦 Видео
97. Глюкоза (структурные формулы)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Моносахариды. Глюкоза. 11 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

51. Углеводы. Глюкоза. Фруктоза (чась 2)Скачать

8 класс. Степень окисления.Скачать