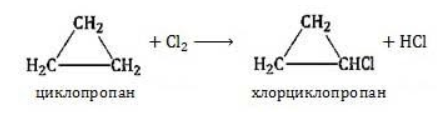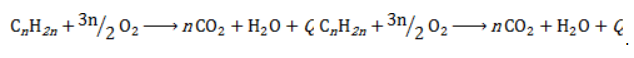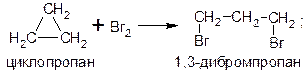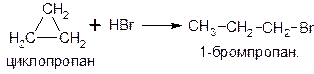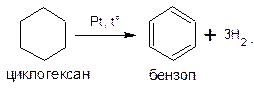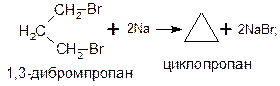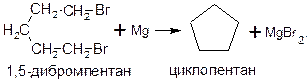Количество углеродных атомов в цикле, образующем молекулу, влияет на свойства циклоалканов, проявляемые в различных видах химических взаимодействий. Соединения с малыми циклами, в которых существенную роль играет угловое напряжение, отличаются неустойчивостью и близки по свойствам к непредельным углеводородам. Чем больше звеньев в цикле, тем сильнее проявляются свойства, присущие алканам.
Видео:5.1. Циклоалканы: Строение, изомерия. ЕГЭ по химииСкачать

Реакции присоединения
Участие в процессах этого типа, связанных с разрывом замкнутого участка молекулы, свойственно циклопропану 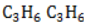
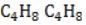
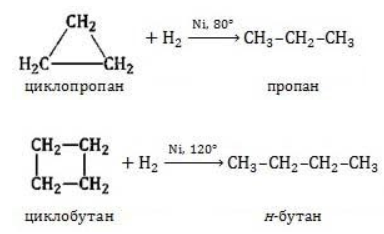
Гидрирование
Условиями реакции являются нагревание и присутствие катализатора. Цикл размыкается с образованием алкана:
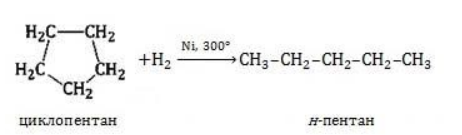
Для вступления в реакцию циклопентана требуются более жесткие условия:
Это единственная реакция присоединения, в которую способен вступать циклопентан. Сходство химических свойств циклоалканов с более высоким углеродным числом обусловливает их неучастие в реакциях присоединения.
Галогенирование
Продуктом этой реакции становится дигалогеналкан:
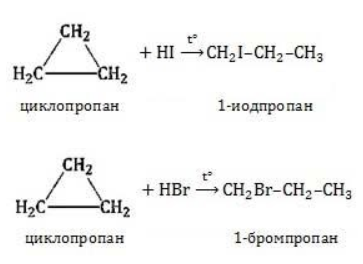
Гидрогалогенирование
Циклопропан реагирует в водном растворе с галогенводородами:
Присоединять галогенводород способны и гомологи циклопропана с углеводородным радикалом и трехчленным циклом. В процессах гидрогалогенирования циклоалканов соблюдается правило Марковникова, согласно которому водород присоединяется к максимально гидрогенизированному атому углерода:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции замещения
Для циклоалканов со слабо напряженным или ненапряженным циклом (
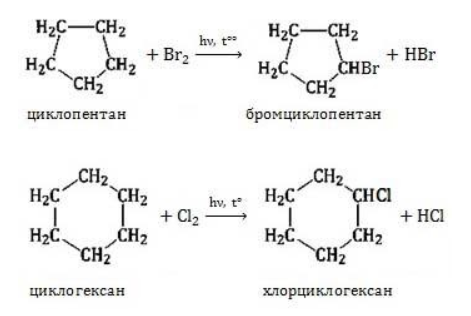
Галогенирование
В результате реакции образуется галогенциклоалкан:
Хлорирование малого цикла также может происходить без его разрыва, если температура реакции не превысит 100° C:
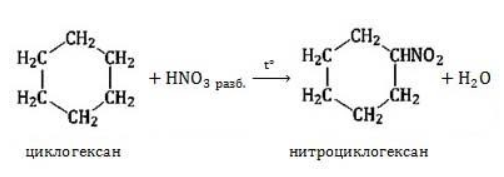
Нитрование
Азотная кислота должна быть разбавленной. Продукт взаимодействия – нитроциклоалкан:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Окисление циклоалканов
Реакции окисления одинаково свойственны всем циклоалканам. Аналогично предельным незамкнутым углеводородам, они не реагируют с водным раствором 
Мягкое окисление
При мягком окислении воздухом на хлориде кобальта получают алициклические кислородсодержащие соединения (кетон и спирт):
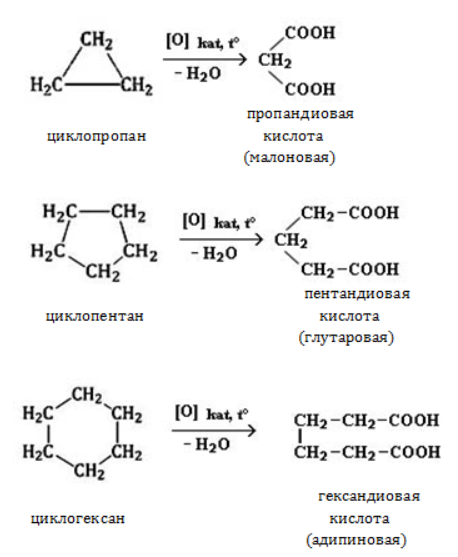
Жесткое окисление
С использованием катализатора воздействие сильного окислителя (например, разбавленной азотной кислоты) на циклоалкан приводит к образованию двухосновных кислот. Реакция протекает в жестких условиях:
Полное окисление (горение)
В общем виде уравнение горения циклоалканов записывается:
Инициирует реакцию контакт с открытым пламенем.
Видео:5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать

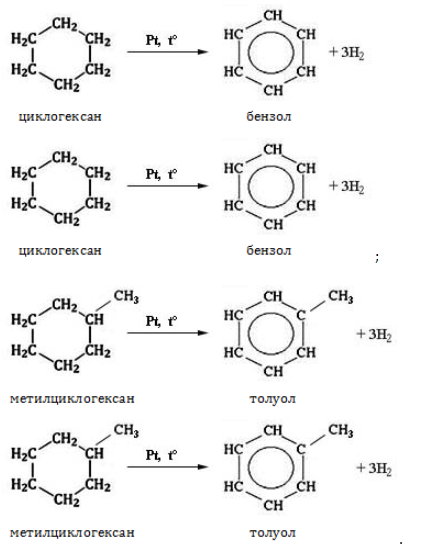
Реакция отщепления
Нагревание в присутствии металлического катализатора приводит к дегидрированию циклоалканов – отщеплению водорода и образованию ароматического соединения бензольного ряда:
Видео:8 класс. Составление уравнений химических реакций.Скачать

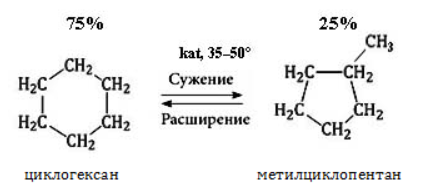
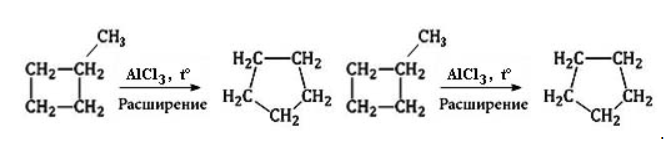
Изомеризация
Циклоалканы способны изомеризоваться с перегруппировкой атомов в углеродном скелете. Процесс протекает на платине, хлориде или бромиде алюминия и сопровождается сужением либо расширением цикла. Образование средних циклов происходит легче, и они отличаются большей устойчивостью:
Реакция идет в обоих направлениях до установления равновесия.
Для низших циклоалканов предпочтительной оказывается изомеризация с расширением цикла, так как она ведет к ослаблению углового напряжения в молекуле. Так, метилциклобутан переходит в циклопентан необратимо:
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Заключение
Циклоалканы, находящиеся в начале гомологического ряда, сочетают в своих химических взаимодействиях свойства предельных и непредельных углеводородов линейного строения. Комбинация свойств вызвана, с одной стороны, особыми условиями образования непрочных изогнутых связей в простейших циклах, и, с другой стороны, насыщенностью соединений.
Высшие циклоалканы практически не отличаются по химическим свойствам от алканов, так как их макроциклы не оказывают деформирующего влияния на строение химических связей.
Видео:Уравнивание реакций горения углеводородовСкачать

Химические свойства циклопропана и циклобутана
«Визитной карточкой» углеводородов с малыми циклами является низкая устойчивость: для них характерны реакции присоединения водорода, галогенов и галогеноводородов, приводящие к размыканию цикла. Наиболее легко эти реакции протекают с участием циклопропана:
Циклобутан вступает в аналогичные реакции, но в более жестких условиях. Его гидрирование начинается при температуре около 180 о С:
Галогенирование и гидрогалогенирование циклобутана протекают при нагревании:
Склонность малых циклов, особенно циклопропана, к раскрытию и реакциям присоединения объясняют особенностями химических связей между атомами углерода в их молекулах. Рассмотрим в качестве примера строение молекулы циклопропана. Исходя из того, что трехчленный цикл является плоским равносторонним треугольником, валентные углы между атомами углерода должны быть равными 60 о , то есть существенно отличаться по величине от соответствующего sp 3 -гибридизации тетраэдрического угла. Такого сильного искажения валентного угла в действительности не происходит: электронные облака, связывающие атомы углерода, перекрываются не на прямой, соединяющей ядра, а вне ее (рис. 4). Поскольку в этом случае максимальная электронная плотность располагается вне линии, соединяющей ядра атомов, образовавшаяся связь приобретает частично ненасыщенный характер и становится похожей на π-связь в алкенах. Связи такого типа называют «банановыми».
Рисунок 4. Схема перекрывания электронных облаков в молекуле циклопропана (черными точками обозначены ядра атомов углерода).
Химические свойства циклоалканов с пятью и более атомами углерода в цикле
Циклоалканы с пятью и более атомами углерода в цикле по химическим свойствам практически не отличаются от алканов. Так, при их хлорировании происходит замещение атома водорода на галоген:
При действии разбавленной азотной кислоты при нагревании протекает реакция нитрования:
Характерной особенностью циклогексана и его гомологов является реакция дегидрирования с образованием ароматических углеводородов, которая протекает при пропускании их паров над никелем или платиной при температуре около 300 о С:
НАХОЖДЕНИЕ В ПРИРОДЕ И СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ
В природе наиболее распространены циклоалканы, содержащие наиболее устойчивые пяти- и шестичленные циклы. Они входят в состав нефти, а также содержатся в эфирных маслах некоторых растений.
Общим способом получения циклоалканов является действие активных металлов (натрия, лития, магния, цинка) на дигалогенпроизводные алканов. Так, циклопропан можно получить действием натрия на 1,3-дибромпропан, а циклопентан – действием магния на 1,5-дибромпентан:
Циклогексан чаще всего получают гидрированием бензола в присутствии катализаторов. Эта реакция обратима (сравните с реакцией дегидрирования циклогексана). Чтобы сместить равновесие в сторону образования циклогексана, процесс ведут при повышенном давлении:
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Даны вещества:
| а) | 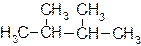 | в) |  |
| б) | 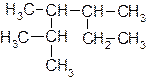 | г) |  |
Назовите каждое из веществ в соответствии с правилами номенклатуры ИЮПАК.
2. Даны вещества
| а) б) в) г) д) е) | 2,3,4-триметилпентан; 2,4-диметил-3-этилпентан; 2,2,4,4-тетраметилгексан 2-бром-3-метилпентан; 3,4-диэтил-2,5-дихлоргексан 3-нитро-3-этилпентан. |
Напишите структурные формулы этих веществ.
3. Алкан состава С7Н16 имеет девять изомеров (включая нормальный гептан). Напишите структурные формулы этих веществ и дайте им названия.
4. Напишите уравнения следующих реакций, указывая условия их протекания:
| а) б) в) | нитрования 2-метилбутана; ароматизации гексана; изомеризации пентана.* |
*В этой реакции образуется одновременно два изомера. При написании уравнения реакции достаточно в качестве продукта привести один из них.
5. Напишите уравнения реакций бромирования и хлорирования 2,3-диметилбутана. Сколько разных монохлорзамещенных продуктов образуется при хлорировании этого вещества?
6. Напишите уравнения реакций, позволяющих с помощью реакции Вюрца получить
7. Напишите структурные формулы всех алканов, образующихся при действии металлического натрия на смесь иодэтана и 2-иодпропана.
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
карбид алюминия → метан → бромметан → этан → нитроэтан.
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутан → изобутан → 2-бром-2-метилпропан.
10. Напишите уравнения реакций, с помощью которых можно получить 2,3-диметилбутан из пропана в две стадии.
11. Алкан, выделившийся на аноде при электролизе водного раствора пропионата натрия (CH3CH2COONa), пропустили над платиновым катализатором при температуре 300 о С. Какие продукты могли образоваться в результате? Напишите уравнения возможных реакций.
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎬 ВидеоВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Органическая химия Углеводород Пропан Циклопропан Дегидрирование Гидрирование 10 класс ЕГЭ ВидеоурокСкачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Нитрование алкановСкачать  Составление уравнений реакций (по валентности). 8 класс.Скачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Химические свойства алканов. 1 часть. 10 класс.Скачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать  Составление уравнений реакций горения. 11 класс.Скачать  Составление уравнений реакций. 1 часть. 8 класс.Скачать  |