- Хлороводород, соляная кислота (HCl)
- Хлорноватистая кислота (HClO) и ее соли
- Хлористая кислота (HClO2) и ее соли
- Хлорноватая кислота (HClO3) и ее соли
- Хлорная кислота (HClO4) и ее соли
- Оксид хлора (I), оксид дихлора ( Cl2O)
- Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
- Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
- Оксид хлора (VII) (Cl2О7)
- Свойства хлороводорода, способы получения
- Хлороводород — что это такое, формула
- Физические и химические свойства
- Взаимодействие с основаниями
- Способы получения, область применения
- Техника безопасности
- Написать уравнение реакции присоединения хлороводорода к этилену?
- Подскажите, пожалуйста, реакцию присоединения хлороводорода с бутин — 2?
- Уравнение реакции пентена — 2 с хлороводородом?
- Почему гексан не вступает в реакцию присоединения хлороводорода?
- Составьте уравнение реакций присоединение хлороводорода к пропену, гидратация этина , хлорирование бензола?
- Запишите уравнения реакций присоединения водорода и брома к этилену(этену)?
- Напишите пожалуйста реакцию присоединения хлороводорода к бутину — 1 (первая стадия), Назовите полученное вещество?
- Написать уравнение реакции взаимодействия толуола с этиленом в присутствии хлорида алюминия?
- Запишите уравнение реакции присоединения хлороводорода к молекуле циклобутана и укажите условия реакций?
- Написать примеры реакций(хотя — бы по 2 примера) : — Замещения : циклоалканы и ароматические углеводороды — Присоединения : Гидрирование пропилена, соляной кислоты к этилену ( с условиями), хлора к эт?
- Уравнение : Присоединение хлороводорода к гексину — 2?
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
- при очень сильном нагревании
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
- взаимодействует с основными и амфотерными оксидами:
- реагирует с основаниями и амфотерными гидроксидами:
- Вступает в реакцию с аммиаком:
- взаимодействует с солями более слабых кислот:
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. При этом анион Cl — окисляется до свободного хлора:
2Cl — — 2e — = Cl2 0
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
- Реакция гипохлоритов с диоксидом углерода и водой :
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO –слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая кислота разлагается:
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
- Разложениегипохлоритов при нагревании:
- Кислоты, более сильные, чем хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
- Взаимодействуют с другимисолями, если продуктом является слабый электролит:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
- Вступает в реакциис щелочами с образованием хлоритов:
- При длительном хранении разлагается:
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
- реагируют с сильными кислотами:
- являются слабыми восстановителями и сильными окислителями в кислой среде:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
- Окисляет некоторые вещества:
- Разлагается при слабом нагревании:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
- Хлораты сильные окислители.
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
Видео:Получение хлороводородаСкачать
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с щелочами с образованием перхлоратов:
- Как сильный окислитель окисляет многие вещества:
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильнымиокислителями
- Взаимодействуют с сильными кислотами:
- При нагревании более 550ºС разлагаются:
Оксиды хлора
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
- Является сильным окислителем:
- При температуре выше 20ºС или на свету разлагается:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
- Разлагается в концентрированной хлороводородной кислоте:
- Проявляет окислительно-восстановительные свойства:
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
- При нагревании разлагается:
Видео:Опыты по химии. Получение хлороводорода и растворение его в водеСкачать

Свойства хлороводорода, способы получения
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать

Хлороводород — что это такое, формула
Хлороводород — это бесцветный газ с резким неприятным запахом.
Формула: HCl
Строение его молекулы определяет название соединения. Атомы хлора и водорода соединены ковалентной полярной связью.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Физические и химические свойства
- Тяжелее воздуха.
- Соединение хорошо растворяется в воде. Раствор хлороводорода в воде называют соляной кислотой.
- Хлороводород может менять агрегатное состояние под воздействием температуры. При -85,1°C образуется бесцветная жидкость, а при -114,22°C он переходит в твердое (кристаллическое) состояние.
- Имеет способность поглощать пары воды из воздуха, поэтому при высокой влажности дымится.
- Молярная масса 36,4606 г/моль.
- Плотность равна 1,477 г/л, в газообразном состоянии при 25 °C.
- Температура плавления −114,22 °C.
- Температура кипения −85,1 °C.
- Температура разложения 1500 °C.
Раствор хлороводорода в воде называют соляной кислотой. Процесс растворения можно описать с помощью следующего уравнения реакции:
H C l + H 2 O → H 3 O + + C l —
При растворении хлороводорода выделяется большое количество теплоты.
Соляную кислоту относят к сильным одноосновным кислотам. Соединение активно вступает в химические реакции со следующими веществами:
- металлы, расположенные в ряду напряжений с левой стороны от водорода;
- основные и амфотерные оксиды;
- основания;
- соли.
В результате такого взаимодействия формируются соли соляной кислоты — хлориды:
M g + 2 H C l → M g C l 2 + H 2 ↑
F e O + 2 H C l → F e C l 2 + H 2 O
Хлориды можно часто встретить в природном мире. Вещества широко применяются в современной промышленности. В качестве примеров можно привести галит N a C l и сильвин K C l . В распространенных случаях хлориды обладают высокой степенью растворимости в воде и способны полностью диссоциировать на ионы в водных растворах (являются сильными электролитами). Слабой растворимостью отличаются следующие соединения:
- хлорид свинца ( I I ) P b C l 2 ;
- хлорид серебра A g C l ;
- хлорид ртути ( I ) H g 2 C l 2 ;
- хлорид меди ( I ) C u C l .
Свойства
В присутствии сильных окислителей или в процессе электролиза хлороводород способен проявлять свойства восстановителя, при этом окисляясь с выделением газообразного хлора:
M n O 2 + 4 H C l → M n C l 2 + C l 2 ↑ + 2 H 2 O
В условиях повышенной температуры происходит окисление хлороводорода кислородом в присутствии катализатора, роль которого играет хлорид меди ( I I ) C u C l 2 :
4 H C l + O 2 → 2 H 2 O + 2 C l 2 ↑
Концентрированная соляная кислота взаимодействует с медью, что сопровождается образованием комплекса одновалентной меди:
2 C u + 4 H C l → 2 H [ C u C l 2 ] + H 2 ↑
Смесь, в состав которой входят три объемные части концентрированной соляной кислоты и одна объемная часть концентрированной азотной кислоты, носит название «царская водка». Данная смесь способна растворять золото и платину.
«Царская водка» характеризуется высокой окислительной способностью, что объясняется наличием в составе смеси хлористого нитрозила N O C l и хлора, находящихся в равновесии с исходными веществами:
4 H + + 3 C l — + N O 3 — → N O C l + C l 2 + 2 H 2 O
За счет большого содержания хлорид-ионов в растворе происходит связывание металла. В результате образуется хлоридный комплекс, что является причиной его растворения:
3 P t + 4 H N O 3 + 18 H C l → 3 H 2 [ P t C l 6 ] + 4 N O + 8 H 2 O
В процессе присоединения хлороводорода к серному ангидриду происходит образование хлорсульфоновой кислоты H S O 3 C l :
S O 3 + H C l → H S O 3 C l
Хлороводород вступает в реакции присоединения по кратным связям в органических соединениях (электрофильное присоединение):
R — C H = C H 2 + H C l → R — C H C l — C H 3
R — C ≡ C H + 2 H C l → R — C C l 2 — C H 3
Видео:Уравнивание реакций горения углеводородовСкачать

Взаимодействие с основаниями
Соляная кислота взаимодействует практически со всеми основаниями. При этом протекают реакции ионного обмена, в результате которых получают соль и воду:
- с гидроксидом натрия: H C l + N a O H → N a C l + H 2 O ;
- с гидроксидом меди: 2 H C l + C u ( O H ) 2 → C u C l 2 + 2 H 2 O ;
При смешении соляной кислоты с аммиаком протекает реакция присоединения. В результате взаимодействия образуется соль в виде хлорида аммония. Уравнение реакции будет выглядеть так:
H C l + N H 3 → N H 4 C l
Соляная кислота также вступает в реакцию с амфотерными гидроксидами, которые в данном случае проявляют основные свойства. Взаимодействие с гидроксидом цинка:
2 H C l + Z n ( O H ) 2 → Z n C l 2 + 2 H 2 O
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Способы получения, область применения
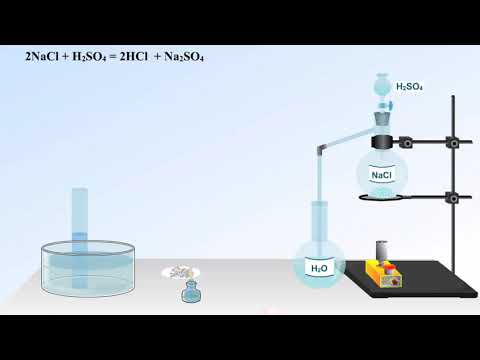
Лабораторный способ получения хлористого водорода заключается в реакции концентрированной серной кислоты с твердым хлоридом натрия (поваренной солью) в условиях повышенной температуры:
N a C l + H 2 S O 4 → N a H S O 4 + H C l ↑
Хлороводород синтезируют с помощью гидролиза ковалентных галогенидов, к примеру, хлорида фосфора(V), тионилхлорида S O C l 2 , и гидролиза хлорангидридов карбоновых кислот:
P C l 5 + H 2 O → P O C l 3 + 2 H C l
R C O C l + H 2 O → R C O O H + H C l
Устаревший промышленный способ получения хлористого водорода заключался в методике Леблана. В процессе реакции твердый хлорид натрия взаимодействует с концентрированной серной кислотой.
В современной промышленности хлороводород производят с помощью прямого синтеза из простых веществ:
H 2 + C l 2 ⇄ 2 H C l + 184 , 7 к Д ж
В промышленных масштабах хлористый водород производят на специальных установках путем сжигания водорода в хлоре. Причем водород попадает в пламя в небольшом избытке. Тогда весь объем подаваемого хлора реагирует, и на выходе получается продукт более высокого качества.
Газообразный хлороводород практически не используется из-за его физических и химических характеристик. Широкое применение находит соляная кислота:
- Металлургия. Вещество используют, как средство для очистки руд. Может также применяться для удаления ржавчины и производства паяльной кислоты, необходимой в области точного машиностроения.
- Производство бытовой химии.
- Медицина. Кислота применяется в смеси с пепсином в качестве лекарства от пониженной кислотности желудка.
- Пищевая промышленность. Регулятор кислотности (пищевая добавка Е 507 ) .
Техника безопасности
При попадании хлороводорода в дыхательные пути может наступить сильное удушье. А его водный раствор высокой концентрации вызывает химические ожоги. Поэтому работать с хлористым водородом и соляной кислотой следует только в маске (респираторе), защитных перчатках и очках.
При вдыхании газа необходимо немедленно вывести пострадавшего на воздух и при необходимости сделать искусственное дыхание. В случае проглатывания соляной кислоты требуется промывание желудка.
Если кислота попала на кожу, пораженный участок следует промыть водой и обработать слабым раствором соды, который нейтрализуют кислоту. В случае попадания на слизистые оболочки после промывания нужно закапать глаза, нос или горло раствором новокаина и дикаина с адреналином.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Написать уравнение реакции присоединения хлороводорода к этилену?
Химия | 5 — 9 классы
Написать уравнение реакции присоединения хлороводорода к этилену.
CH2 = CH2 + HCL — > ; CH3 — CH2(CL).
Видео:ХЛОРОВОДОРОД | Соляная кислота | Химия 9 классСкачать

Подскажите, пожалуйста, реакцию присоединения хлороводорода с бутин — 2?
Подскажите, пожалуйста, реакцию присоединения хлороводорода с бутин — 2.
Видео:Решение цепочек превращений по химииСкачать

Уравнение реакции пентена — 2 с хлороводородом?
Уравнение реакции пентена — 2 с хлороводородом.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Почему гексан не вступает в реакцию присоединения хлороводорода?
Почему гексан не вступает в реакцию присоединения хлороводорода?
Видео:Получение хлороводородаСкачать

Составьте уравнение реакций присоединение хлороводорода к пропену, гидратация этина , хлорирование бензола?
Составьте уравнение реакций присоединение хлороводорода к пропену, гидратация этина , хлорирование бензола.
Видео:Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Запишите уравнения реакций присоединения водорода и брома к этилену(этену)?
Запишите уравнения реакций присоединения водорода и брома к этилену(этену).
Напишите пожалуйста реакцию присоединения хлороводорода к бутину — 1 (первая стадия), Назовите полученное вещество?
Напишите пожалуйста реакцию присоединения хлороводорода к бутину — 1 (первая стадия), Назовите полученное вещество?
Написать уравнение реакции взаимодействия толуола с этиленом в присутствии хлорида алюминия?
Написать уравнение реакции взаимодействия толуола с этиленом в присутствии хлорида алюминия.
Запишите уравнение реакции присоединения хлороводорода к молекуле циклобутана и укажите условия реакций?
Запишите уравнение реакции присоединения хлороводорода к молекуле циклобутана и укажите условия реакций.
Написать примеры реакций(хотя — бы по 2 примера) : — Замещения : циклоалканы и ароматические углеводороды — Присоединения : Гидрирование пропилена, соляной кислоты к этилену ( с условиями), хлора к эт?
Написать примеры реакций(хотя — бы по 2 примера) : — Замещения : циклоалканы и ароматические углеводороды — Присоединения : Гидрирование пропилена, соляной кислоты к этилену ( с условиями), хлора к этилену — Отщепления : дегидрирование этана(отщепление водорода при температуре 300 — 600, катализатор Al2O3), дегидратация этанола(отщепление воды при температуре 170, катализатор серная кислота), дегидрохлорирование хлорэтана(отщепление хлороводорода в присутствии спиртового растворащелочи) — Изомеризации : пентана в присутсвии хлорида алюминия 450 градусов.
Уравнение : Присоединение хлороводорода к гексину — 2?
Уравнение : Присоединение хлороводорода к гексину — 2.
На странице вопроса Написать уравнение реакции присоединения хлороводорода к этилену? из категории Химия вы найдете ответ для уровня учащихся 5 — 9 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
N(SO2) = m / M = 5г / 64г / моль = 0, 078 моль n(CO2) = m / M = 3г / 44г / моль = 0, 068 моль Выходит, что химическое количество SO2 больше, чем СО2. Так как чтобы получить число молекул, надо химическое количество умножить на постоянную Авогадро, т..
2017 Археологи нашли ДНК мамонта.
Решение задачи находится на фото.
Ьаьвлвлвллылылы. А к к.
Пойдет : 2NH₄Cl + Cu(OH)₂ = CuCl₂ + 2NH₃↑ + 2H₂O.
Аха CuCl2 + 2NH4OH = 2NH4Cl + Cu(OH)2.
Al2O3 (оксид алюминия 3) Al(OH)3 (гидроокисид алюминия 3) Ga2O3 (оксид галлия 3) Ga(OH)3 (гидроокисид галлия 3) они все амфотерные.
FeCl3 + NaOH = FeOH + NaCl3 K2CO3 + HNO3 = K2NO3 + H2CO3 BaCl2 + Na2SO4 = BaSO4 + NaCl2.
Селен назван в честь Луны.
HCl ; H2SO4 ; — кислоты ; Cu(NO3)2 ; FeCl3 ; — соли ; Na2O ; BaO ; Mg(OH)2 — основные оксиды ; СО2 — кислотный оксид ; KOH — основание( гидроксид калия).









