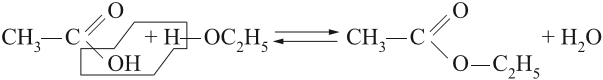
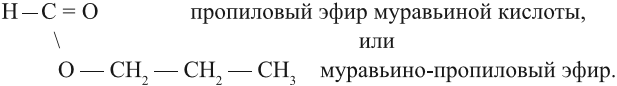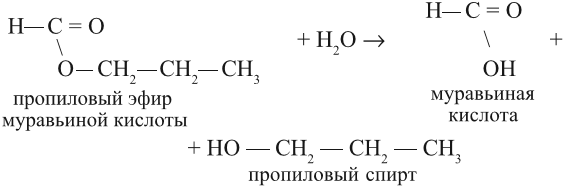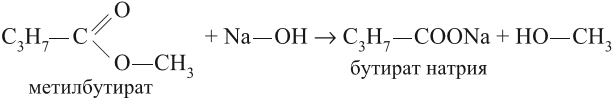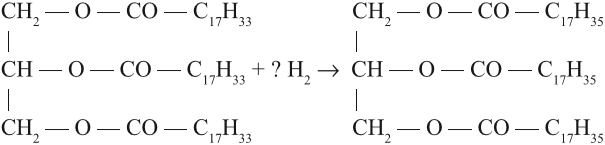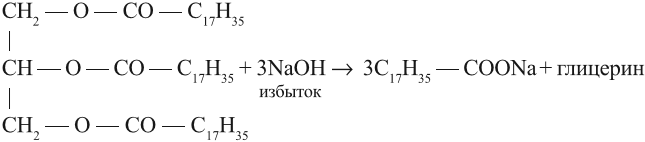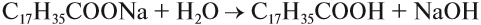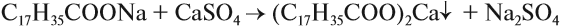Сложные эфиры — это продукт взаимодействия спирта с кислородсодержащей кислотой.
Задание 25.1. Составьте уравнение реакции глицерина с азотной кислотой. Назовите полученное соединение.
Так, при взаимодействии глицерина с азотной кислотой получается сложный эфир нитроглицерин.
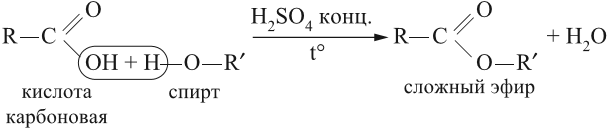
Разберём свойства и способ получения эфиров карбоновых кислот. Такие эфиры получаются при помощи реакции этерификации, т. е. при взаимодействии спирта с карбоновой кислотой в присутствии концентрированной серной кислоты, например:
Название этого и других сложных эфиров составляют из названий кислоты и спирта. Например, название этого эфира звучит так: этиловый эфир уксусной кислоты, или уксусно-этиловый эфир.
Очень часто употребляют названия эфиров, совпадающие с названиями солей данных кислот. Например, «химическое» название нитроглицерина «тринитрат глицерина». Это название совпадает с названиями солей азотной кислоты.
Вопрос. Как называются соли уксусной кислоты?
Поскольку углеводородный радикал спирта (в данной случае) называется этил, а соли уксусной кислоты — ацетаты, то полученный сложный эфир называется этилацетатом.
Задание 25.2. Составьте уравнения реакций получения
Дайте другие названия полученным эфирам.
Для составления таких реакций нужно:
1. Выяснить, какая кислота образует данную соль (урок 24.4);
2. Выяснить, какой спирт имеет соответствующий радикал;
3. Записать формулы кислоты и спирта так, чтобы функциональные группы были рядом («голова к голове»);
4. Отщепить молекулу воды и соединить остатки молекул простой связью:
5. Назвать сложный эфир.
При правильном выполнении задания вы получите для пропилформиата:
Сложные эфиры легко подвергаются гидролизу, т. е. взаимодействуют с водой, образуя исходные кислоту и спирт:
Задание 25.3. Составьте уравнения реакций гидролиза для пропилформиата, метилбутирата.
Вопрос. Могут ли вещества, полученные в результате реакции гидролиза, реагировать друг с другом? Что при этом получается?
Поскольку полученные кислота и спирт могут реагировать друг с другом, реакция гидролиза сложного эфира обратима. Она происходит в присутствии растворов кислот (Н + ). В присутствии щелочей реакция гидролиза сложного эфира становится необратимой (!).
Вопрос. Реагирует ли с раствором щелочи:
Что получается в результате возможной реакции?
В результате щелочного гидролиза образуется соль кислоты и спирт:
Вопрос. Почему эта реакция необратима?
Задание 25.4. Составьте уравнения реакций щелочного гидролиза для:
Назовите полученные вещества.
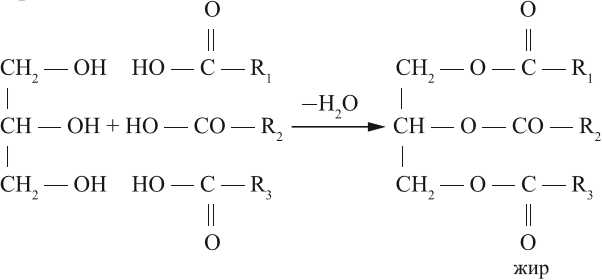
Жидкие сложные эфиры, как правило, имеют приятный запах, являются хорошими растворителями. Но твёрдые сложные эфиры одноатомных спиртов запаха не имеют и по внешнему виду напоминают жир. Но это не жир, это воск. Настоящий ЖИР — это сложный эфир трёхатомного спирта глицерина и карбоновых кислот:
В состав природных жиров могут входить остатки как предельных кислот (масляная, стеариновая, пальмитиновая С15Н31СООН), так и непредельных (олеиновая С17Н33СООН) кислот.
Задание 25.5. Напишите формулы масляной и стеариновой кислот.
Если в составе жира преобладают твёрдые предельные кислоты, то жир — твёрдый; если непредельные (жидкие) кислоты, то жир — жидкий.
Задание 25.6. Напишите по приведённой выше схеме уравнения реакций:
- глицерин + стеариновая кислота;
- глицерин + олеиновая кислота.
Какое агрегатное состояние имеет каждый из полученных жиров?
Названия жиров составляют, исходя из названий кислот, входящих в его состав, так как спирт, образующий жир, один и тот же — глицерин. Так, если в состав жира входят три остатка пальмитиновой кислоты, то он называется трипальмитин.
Задание 25.7. Назовите жиры, полученные в предыдущем задании 25.6.
Задание 25.8. Сравните состав жиров: тристеарина и триолеина. Сделайте вывод: можно ли жидкий жир (триолеин) превратить в твёрдый (тристеарин)? Как?
На практике часть жидких жиров превращают в твёрдые путем гидрирования, т. е. насыщения водородом:
Задание 25.9. Расставьте коэффициенты в этом уравнении.
Твёрдые жиры медленнее портятся (почему?), их легче хранить, поэтому реакция гидрирования имеет большое практическое значение. Полученный искусственный жир называется саломас. Из него получают маргарин, смазочные материалы, мыло. В последнем случае проводят щелочной гидролиз саломаса твёрдого жира:
Задание 25.10. Назовите полученное соединение.
Мыло — это соль очень слабой органической кислоты и сильного основания (щелочи).
Вопрос. Какой процесс происходит с такими солями в растворе?
Поэтому мыло в растворе подвергается гидролизу, т. е. реагирует с водой; при этом образуются исходные продукты, т. е. щёлочь и кислота:
Получившаяся щёлочь «щиплет» глаза, разъедает кожу рук, некоторые ткани. Кроме того, мыло плохо моет в жёсткой воде (см. урок 9.2), так как реагирует с солями кальция и магния (именно они делают воду жёсткой), образуя нерастворимые соединения:
Поэтому к стеарату натрия (он составляет около 60 % хозяйственного мыла) добавляют вещества, которые уменьшают нежелательное действие чистого мыла. Так получают туалетные мыла и другие моющие составы.
Жиры применяют также для получения стеарина (смесь твёрдых предельных кислот), олифы, клеёнок и др. материалов.
Кроме того, жиры — обязательный компонент нашей пищи. Они являются источником энергии, которая выделяется при биохимическом окислении жира (при окислении жиров выделяется около 9 ккал/г энергии), необходимы для усвоения витаминов. Жидкие жиры более полезны для здоровья, чем твёрдые.
Видео:Гидролиз солей. 9 класс.Скачать

Выводы
Сложные эфиры образуются при взаимодействии спиртов и кислородсодержащих кислот в результате реакции этерификации. Жиры — это сложные эфиры глицерина и жирных кислот. Жиры — обязательный компонент нашей пищи.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Сложные эфиры. Жиры Химия
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Сложные эфиры. Жиры
Продолжить формирование системы знаний о классах органических соединений и генетической связи между ними; способствовать закреплению понимания взаимосвязи применения, свойств и химического строения веществ.
1. Закрепить знания о сложных эфирах, их номенклатуре, реакции этерификации.
2. Дать понятия о физических и химических свойствах сложных эфиров, механизме реакции этерификации.
3. Развить понятие о водородной связи, взаимном влиянии атомов, воздействии этих явлений на свойства веществ.
4. Способствовать развитию эрудиции, логического и ассоциативного мышления учащихся.
Методы и приемы: словесные, наглядные, практические – в логической взаимосвязи.
Тема урока «Сложные эфиры. Жиры». Форма проведения урока – лекция-шоу. Вам, конечно, знакомо английское слово «show». Оно означает «показывать». Заимствована лекция-шоу из интенсивных методик, применяемых в обучении бизнесменов. Лекция-шоу предполагает донесение основной информации до учащихся через пиктограммы – логические рисунки, где в символах и условных знаках «зашифровано» содержание изучаемого. Чтобы расшифровать пиктограмму, нужно понять ее внутреннюю логику, соединив усилия восприятия, воображения и мышления, активно работая над изучаемым материалом, в результате чего содержание усваивается прочно. Как девиз лекциям-шоу очень соответствуют слова А.Эйнштейна: «Самое лучшее, что может быть, – это видеть и понимать». Внимательно смотреть, стараться понять и применять к учебной ситуации знания, которыми вы владеете, – все это требуется от вас сейчас на уроке.
Подготовка к изучению нового материала
Сначала приведем в активное состояние имеющиеся у вас знания. На доске даны названия веществ: калий, медь, оксид магния, оксид углерода(IV), гидроксид натрия, карбонат натрия, серная кислота, этанол, этановая кислота, этаналь, хлор, хлороводород.
С какими из перечисленных веществ вступит в реакцию:
а) этиловый спирт (шесть реакций);
б) уксусная кислота (семь реакций)?
Желающие учащиеся записывают на доске по два уравнения реакций и комментируют, какие свойства отражают эти уравнения, какой тип реакции и как называются продукты.
Вывод: спирты и карбоновые кислоты взаимодействуют между собой с образованием сложных эфиров.
Изучение нового материала
(последовательная демонстрация
и комментирование пиктограмм)
Пиктограмма 1 отражает то, что реакция карбоновой кислоты со спиртом – это реакция замещения, но имеет собственное название: реакция этерификации (от греч. 
Эфирами были названы рассматриваемые вещества в эпоху алхимии, когда названия давались не случайно, а в соответствии с ярко выраженными их свойствами. Самым «выдающимся» свойством эфиров является летучесть, проявляющая себя в наличии запаха.
Назовите эфиры, формулы которых приведены на пиктограмме 1. Обратите внимание на свойственный эфирам запах: этилбутирату – ананаса, бутилбутирату – персика, пентилформиату – вишни, изопентилацетату – груши, этилбензоату – жасмина, изоамиловому эфиру изовалериановой кислоты – яблока.
С какой особенностью строения химик свяжет наличие у вещества выраженного запаха? С отсутствием между молекулами водородных связей.
А почему между молекулами сложных эфиров водородные связи не образуются? Нет связи О–Н, в которой атом водорода соединен с электроотрицательным атомом.
Итак, водородных связей между молекулами нет, а температуры кипения сложных эфиров достаточно высокие. Как химик объяснит эту особенность сложных эфиров? Достаточно длинные молекулярные цепи – межмолекулярное притяжение значительно.
Какие еще физические свойства химик может предсказать для сложных эфиров? Они хорошо растворяются в воде за счет образования водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода молекул эфира. Составьте схему водородной связи на любом примере.
Обратим еще раз внимание на реакцию этерификации. При каких условиях она протекает?
Необходимы повышенная температура и наличие концентрированной серной кислоты. Какова роль серной кислоты? Это катализатор для ускорения реакции и водопоглощающее средство для смещения химического равновесия в сторону образования продуктов реакции.
Составьте уравнения реакций образования эфиров, указанных на пиктограмме 1. При составлении уравнений реакций этерификации обратите внимание на то, что кислоты теряют гидроксигруппу, а спирты – атом водорода. Почему реакция протекает именно так, объясняется ее механизмом. Для понимания этого механизма вспомним взаимное влияние атомов в молекулах карбоновых кислот (пояснение заготовленной на доске схеме).
Пиктограмма 2 отражает то, что, образно говоря, в молекулах карбоновых кислот доминирует 


Пиктограмма 3 на образном языке демонстрирует, что пристрастие к спиртному разрушительно даже для химических связей, а для человека – тем более.
Методом меченых атомов доказано, что молекулы карбоновых кислот в реакции этерификации, которая обычно проводится в присутствии сильных минеральных кислот, отщепляют гидроксигруппу, а молекулы спиртов – атом водорода:
Важнейшее свойство сложных эфиров – гидролиз. Что такое гидролиз? Разложение вещества водой (от греч. 

Как вы считаете, чем будут отличаться продукты реакции, если гидролиз проводится не водой, а водным раствором щелочи? (Образуется не карбоновая кислота, а ее соль, и реакция необратима.)
Составьте в тетрадях уравнения гидролиза:
пентилформиата – водой,
этилбутирата – водой,
пропилформиата – гидроксидом калия,
метилбутирата – гидроксидом лития,
изопропилацетата – гидроксидом натрия.
Прежде чем прокомментировать следующую пиктограмму, составьте уравнения реакций:
этилен + вода,
тримеризация ацетилена,
хлорбензол + гидроксид калия (t, p),
оксид углерода(II) + расплав гидроксида калия,
гидрирование угля,
гидрирование ацетилена,
спиртовое брожение глюкозы.
Проверьте составленные уравнения, сопоставляя их с написанными на доске.
Пиктограмма 4 имеет отношение к реакциям, с которыми мы давно знакомы, многократно составляли их уравнения в «генетических цепочках» и задачах. Объединяет эти реакции то, что впервые их осуществил французский химик Пьер Эжен Марселен Бертло – «король органического синтеза», как называли его современники и называют до сих пор историки химии. Он был не только великим химиком, но и великим человеком – умным, с умелыми руками и горячим сердцем.
На пиктограмме 4 – портрет Бертло в королевской короне, рядом прибор, в котором проводится большинство органических синтезов, в том числе синтез сложных эфиров. Прибор состоит из круглодонной колбы (для равномерного подогрева) с боковым отводом (это колба Вюрца, в ней протекает синтез), водяного холодильника Либиха, где конденсируются продукты реакции, и аллонжа, направляющего конденсат в колбу-приемник. Великому химику Бертло был дан еще редкий дар – дар большой любви. Бертло очень любил свою жену, испытывал потребность видеть ее постоянно. В его лаборатории была отгорожена стеклом кабинка, где мадам Бертло читала, вязала, пока ее муж занимался синтезами. Он всегда мог подойти к ней, поговорить, подержать за руку, и это общение вдохновляло «короля органического синтеза» на новые подвиги во благо науки.
Судьба супругов Бертло соответствует словам Александра Грина: «Они жили счастливо и умерли в один день». Действительно, Бертло не смог пережить утраты жены: она умерла утром, он – вечером. Похоронили их в одной могиле в соборе Парижской богоматери, где хоронят самых выдающихся граждан Франции.
Одним из величайших достижений химика Бертло был синтез жиров – веществ, характерных для живых организмов, т.е. органических веществ в прямом смысле этого слова. Синтезировав жиры, Бертло нанес сокрушительный удар по теории витализма – божественного происхождения органических веществ.
Пиктограмма 5 отражает то, что в работах по синтезу жиров Бертло использовал результаты аналитической деятельности своего современника, французского химика-органика Мишеля Эжена Шевреля, который изучил состав многих жиров и сделал вывод, что жиры – это сложные эфиры трехатомного спирта глицерина и карбоновых кислот, чаще всего стеариновой С17Н35СООН, пальмитиновой С15Н31СООН, масляной С3Н7СООН, олеиновой С17Н33СООН, линолевой С17Н31СООН и линоленовой С17Н29СООН. Последние три кислоты являются непредельными.
Как мы понимаем термин «непредельность»? Как практически доказать, что молекулы непредельных кислот содержат 
Кислоты, входящие в состав жиров, называются «жирными кислотами». Насыщенные кислоты образуют твердые жиры, обычно они животного происхождения (исключение – кокосовое масло). Непредельные кислоты образуют жидкие жиры, они обычно растительного происхождения (исключение – рыбий жир).
Составьте в тетрадях формулы: триолеата глицерина, трипальмитата глицерина, тристеарата глицерина.
Как все сложные эфиры, жиры подвергаются водному и щелочному гидролизу. Щелочной гидролиз сложных эфиров называется омылением.
Составьте в тетрадях уравнения омыления:
тристеарата глицерина – гидроксидом натрия,
трипальмитата глицерина – гидроксидом калия.
Эти реакции используются для получения глицерина и мыла: твердого С17Н35СООNa и жидкого С15Н31СООК.
Жидкие жиры подвергаются гидрированию, например триолетат глицерина переходит в тристеарат глицерина (составить уравнение реакции). Условия гидрирования жидких жиров общие для реакций гидрирования (t, p, кат. Ni). Составленное уравнение реакции отражает химизм производства маргарина из растительного масла.
Пиктограмма 6 содержит информацию о значении сложных эфиров и жиров. Сложные эфиры используются как растворители, ароматизирующие добавки в парфюмерной, фармацевтической и пищевой отраслях промышленности. Жиры – основной источник энергии в живых организмах. При расщеплении 1 г жира освобождается существенно больше энергии, чем в случае белков и углеводов. Жировые прослойки выполняют структурные и защитные функции (жировые капсулы сердца, печени, почек), теплорегулирующую функцию (у животных – обитателей Севера и Антарктиды очень развита жировая подкожная прослойка). Жиры являются источником эндогенной воды (горб верблюда), выполняют гормональные функции, например жировую природу имеют половые гормоны. Витамины одного из классов называются «жирорастворимые», и жиры пищи способствуют усвоению этих витаминов (к ним относятся, например, витамины А и D). Как уже отмечалось, жиры используются для производства мыла и глицерина.
Подведение итогов урока. Оценить наиболее активных учащихся, задать вопрос: «Понравилась ли вам такая форма проведения урока?»
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🌟 ВидеоХимические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать  Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать  Гидролиз солей. 1 часть. 11 класс.Скачать  Электролиз. 10 класс.Скачать  Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  11 класс. Гидролиз солей.Скачать  Гидролиз солей. 10 класс.Скачать  Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать  Гидролиз солей. 2 часть. 11 класс.Скачать  Необратимый гидролиз. Примеры уравнений с объяснением.Скачать  Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Гидролиз | Химия ЕГЭ | УмскулСкачать  |