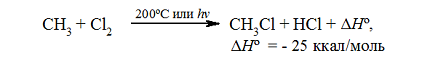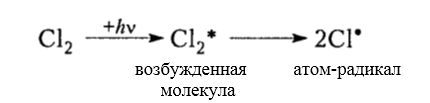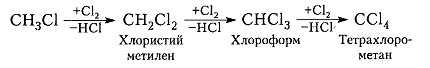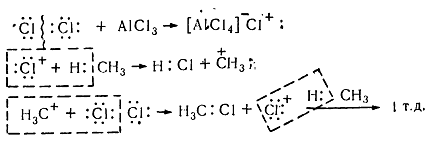Вы будете перенаправлены на Автор24
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
Рисунок 1. Хлорирование метана
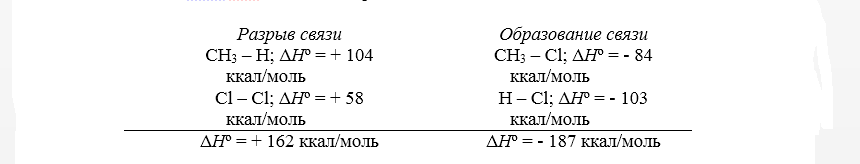
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
Рисунок 2. Хлорирование метана
Суммарный тепловой эффект $Delta underline^circ = — 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
- Готовые работы на аналогичную тему
- Радикальный механизм хлорирования метана
- Закономерности радикального хлорирования метана
- Ионный механизм хлорирования метана
- Метан: способы получения и свойства
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Напишите уравнения реакций: а) изомеризации бутана; б) горения пропана в кислороде; в) первой, второй и третьей стадий хлорирования метана
- Ваш ответ
- решение вопроса
- Похожие вопросы
Готовые работы на аналогичную тему
Видео:Хлорирование метанаСкачать

Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
Рисунок 3. Хлорирование метана
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
Рисунок 5. Хлорирование метана
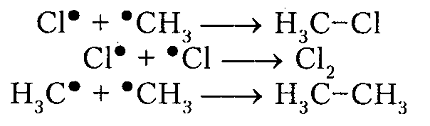
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
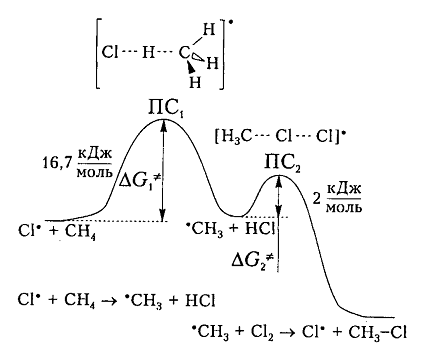
На рис. 6 показана энергетическая диаграмма хлорирования метана.
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи — связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой $-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах — плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
Рисунок 7. Хлорирование метана
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Ионный механизм хлорирования метана
В присутствии катализаторов ( кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Видео:Уравнивание реакций горения углеводородовСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
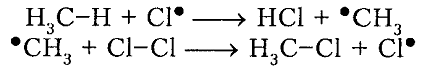
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Видео №3. Как составить изомерыСкачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать  Получение метанаВидео:Решение задач на термохимические уравнения. 8 класс.Скачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Механизм Sr (радикальное замещение)Скачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:8 класс. Составление уравнений химических реакций.Скачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:Получение метанаСкачать  Напишите уравнения реакций: а) изомеризации бутана; б) горения пропана в кислороде; в) первой, второй и третьей стадий хлорирования метанаВидео:Составление формул органических соединений по названиюСкачать  Ваш ответВидео:Составление уравнений реакций горения. 11 класс.Скачать  решение вопросаПохожие вопросы
Популярное на сайте: Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах. Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте. Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так. Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью. |