Действие уксусной кислоты на индикатор
кислоты на полоску
Уксусная кислота имеет
Наличие ионов Гидрогена,
которые образуются при
диссоциации ее молекул,
является причиной изменения
Уравнение электролитической диссоциации уксусной кислоты:
ОПЫТ 2
Реакция уксусной кислоты с металлом
В пробирку с гранулой
цинка наливаем 2 мл
На поверхности гранулы
Составляем уравнения реакций в молекулярной и ионно-молекулярной формах .
ОПЫТ 3
Реакция уксусной кислоты с оснвным (амфотерным) оксидом
В пробирку с порошком
купрум (II) оксида
Составляем уравнения реакций в молекулярной и ионно-молекулярной формах .
2CH 3 COOH + СuO -> 2CH 3 COO — + Cu 2+ + H 2 O
ОПЫТ 4
Реакция уксусной кислоты со щелочью
| Действия | Наблюдение | Выводы | ||||||||
| Действия | Наблюдения | Выводы | |||||
| Действия | Наблюдения | Выводы |
Задание 1
Какие вещества называют карбоновыми кислотами?
Карбоновыми кислотами называют органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом.
Приведите формулы и названия пяти представителей гомологического ряда предельных одноосновных карбоновых кислот.
Метановая (муравьиная) кислота H―COOH,
этановая (уксусная) кислота CH3―COOH,
пропановая (пропионовая) кислота CH3―CH2―COOH,
бутановая (маслянная) кислота CH3―CH2―CH2―COOH,
пентановая (валериановая) кислота CH3―CH2―CH2―CH2―COOH
Задание 2
Напишите формулы следующих кислот:
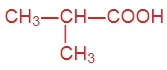 | 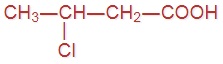 | 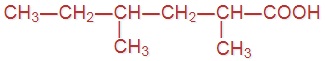 |
Задание 3
Молярная масса предельной одноосновной карбоновой кислоты равна 130 г/моль. Какова молекулярная формула этой кислоты. Дано:
Дано: M(CnH2n+1COOH)=130 г/моль
Найти: формула CnH2n+1COOH−?
Решение
По условию задачи M(CnH2n+1COOH)=130 г/моль, поэтому Mr(CnH2n+1COOH)=130
Mr(CnH2n+1COOH)=(n+1)•Ar(C)+(2n+2)•Ar(H)+2•Ar(O)=(n+1)•12+(2n+2)•1+2•16=12n+12+2n+2+32=14n+46
Составляем алгебраическое уравнение и решаем его:
14n+46=130
14n=130 — 46
14n=84
n=84 : 14
n=6, поэтому формула кислоты: C6H13COOH
Ответ: C6H13COOH
Задание 4
Какие признаки верно отражают свойства уксусной кислоты:
1) газообразное вещество;
2) без запаха;
3) с резким запахом;
4) плохо растворима в воде;
5) слабый электролит?
Задание 5
В пищевой промышленности уксусную кислоту используют как регулятор кислотности и консервант (код E260). Напишите структурные формулы предыдущего и последующего представителей данного гомологического ряда, имеющих коды E236 и E280 соответственно.
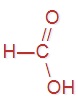 | 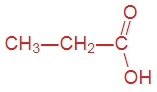 |
Напишите уравнение реакции получения каждой кислоты.
Во время кипячения спирта с окислителем спирт окисляется до карбоновой кислоты:
CH3OH + О2 t,кат. ⟶ HCOOH + H2O
C3H7OH + O2 t,кат. ⟶ C2H5COOH + H2O
Задание 6
В чём сходство и различие химических свойств неорганических и органических кислот? Ответ подтвердите уравнениями химических реакций.
Сходство.
1) Реагируют с активными металлами с образованием солей и выделением водорода:
Ca + 2HCl ⟶ CaCl2 + H2↑
Ca + 2CH3COOH ⟶ (CH3COO)2Ca + H2↑
2) Реагируют с оксидами металлов с образованием солей и воды:
MgO + 2HCl ⟶ MgCl2 + H2O
MgO + 2CH3COOH ⟶ (CH3COO)2Mg + H2O
3) Реагируют с основаниями с образованием солей и воды:
NaOH + HCl ⟶ NaCl + H2O
NaOH + CH3COOH ⟶ CH3COONa + H2O
4) Реагируют с солями, если в результате реакции выделяется газ, образуется осадок или слабый электролит:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑
Различие.
Карбоновые кислоты в присутствии концентрированной серной кислоты вступают во взаимодействие со спиртами, с образованием сложных эфиров (реакция этерификации):
CH3COOH + C2H5OH ⇄ CH3COOC2H5 + H2O (при H2SO4(конц.))
Задание 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этан ⟶ хлорэтан ⟶ этиловый спирт ⟶ уксусный альдегид ⟶ уксусная кислота ⟶ ацетат калия и этиловый эфир уксусной кислоты.
C2H6 + Cl2 ⟶ C2H5Cl + HCl
C2H5Cl + NaOH ⟶ C2H5OH + NaCl
2C2H5OH + O2 t,кат. ⟶ 2CH3CHO + 2H2O
2CH3CHO + O2 кат. ⟶ 2CH3COOH
CH3COOH + KOH ⟶ CH3COOK + H2O
CH3COOH + C2H5OH ⇄ CH3COOC2H5 + H2O (при ⇄H2SO4(конц.))
Задание 8
Достаточно ли 100 г 66%-ного раствора уксусной кислоты для растворения 30 г карбоната кальция? Какая масса ацетата кальция при этом получится?
Дано: m(раствора)=100 г, ω(CH3COOH)=66%, m(CaCO3)=30 г
Найти: m ((CH3COO)2Ca)—?
Решение
1. Рассчитываем массу уксусной кислоты в растворе:
m( CH3COOH )=ω( CH3COOH )•m(раствора):100%=66%•100 г:100%=66 г
2. Количество вещества рассчитываем по формуле: n=m/M, где M ― молярная масса.
M( CH3COOH )=60 г/моль, M(CaCO3)=100 г/моль
n( CH3COOH )=m( CH3COOH )/M( CH3COOH )=66 г : 60г/моль=1,1 моль
n( CaCO3 )=m( CaCO3 )/M( CaCO3 )=30 г : 100 г/моль=0,3 моль
3. Составим химическое уравнение:
CaCO3 + 2CH3COOH ⟶ (CH3COO)2Ca + H2O + CO2↑
По уравнению реакции 1 моль карбоната кальция реагирует с 2 моль уксусной кислоты, поэтому с 0,3 моль карбоната кальция прореагирует в 2 раза больше количества вещества уксусной кислоты, то есть 0,6 моль. По условию задачи имеем 1,1 моль уксусной кислоты, следовательно кислота взята в избытке (её хватит), она реагирует не полностью, поэтому расчеты будем проводить по данным карбоната кальция.
По уравнению реакции количество вещества карбоната кальция и ацетата кальция одинаковое, поэтому:
n( (CH3COO)2Ca )=n( CH3COOH )=0,3 моль
4. Рассчитываем массу карбоната кальция количеством вещества 0,3 моль по формуле: m = n • M, где M ― молярная масса.
M ( (CH3COO)2Ca )=158 г/моль
m( (CH3COO)2Ca )=n ( (CH3COO)2Ca ) • M( (CH3COO)2Ca )=0,3 моль • 158 г/моль=47,4 г
Ответ: уксусной кислоты достаточно; получится 47,4 г ацетата кальция.
Задание 9
Почему жжение от ужаления муравья утихает, если потереть пострадавшее место нашатырным спиртом (водным раствором аммиака)?
Происходит нейтрализация муравьиной кислоты, которая вызывает жжение и содержится в составе жалящей жидкости, с аммиаком, содержашемся в составе нашатырного спирта:
HCOOH + NH3 ⟶ HCOONH4
Нашатырный спирт представляет собой водный раствор аммиака с массовой долей растворенного вещества 10%.
Задание 10
Докажите с помощью уравнений реакций, что муравьиная кислота может проявлять как свойства альдегидов, так и свойства кислот. Муравьиная кислота, в отличие от других карбоновых кислот, содержит альдегидную группу CНO, поэтому как и альдегиды, способна реагировать с аммиачным раствором оксида серебра (при этом происходит восстановление серебра) и со свежеполученным осадком гидроксида меди (II) при нагревании (при этом медь восстанавливается до одновалентной меди) :
HCOOH + Ag2O аммиачный р-р t → H2O + CO2 + 2Ag↓
HCOOH + 2Cu(OH)2 ⟶ Cu2O + CO2 + 3H2O
Задание 12
Есть ли у вас на кухне уксусная кислота? Какие правила техники безопасности необходимо соблюдать при её использовании? Почему?
С уксусной кислотой необходимо обращаться очень осторожно, т.к. её пары могут вызвать ожоги дыхательных путей и слизистых оболочек глаз.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Please wait.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

We are checking your browser. gomolog.ru
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Составление уравнений реакций. 1 часть. 9 класс.Скачать
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1fd0908d5e8751 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
🔥 Видео
Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Составление уравнений химических реакций. 2 часть. 8 класс.Скачать

Составление уравнений реакций. 1 часть. 8 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Составление уравнений реакций горения. 11 класс.Скачать

Электролитическая диссоциация. Тема 9. Расчеты по уравнениям химических реакцийСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Составление уравнений окислительно-восстановительных реакций методом электронного балансаСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Химия. 8 класс. Составление уравнений химических реакций /25.09.2020/Скачать