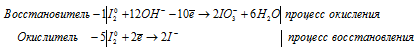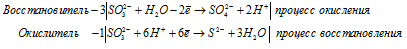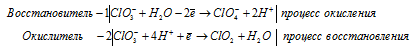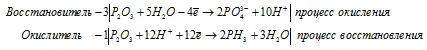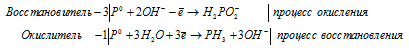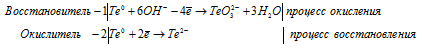Любая окислительно-восстановительная реакция состоит из двух «половинок» — в ходе ОВР идут два процесса — процесс окисления вещества-восстановителя и процесс восстановления вещества-окислителя. Оба эти процесса могут быть описаны соответственными ионными уравнениями, которые потом можно суммировать и получить итоговое общее ионное уравнение реакции, а потом записать молекулярное уравнение.
В качестве примера составим уравнение реакции сероводорода с раствором калия перманганата в кислой среде методом полуреакций. Ранее это уравнение было составлено методом электронного баланса.
В ходе реакции происходит разложение молекул сероводорода на серу и водород, о чем свидетельствует постепенное помутнение раствора перманганата калия (сера выпадает в осадок). Процесс окисления сероводорода запишем в виде уравнения полуреакции окисления:
Поскольку в левой и правой частях схемы кол-во атомов серы и водорода равно, то стрелку можно заменить на знак равенства, уравняв предварительно число зарядов в исходном веществе и продуктах реакции:
Параллельно с помутнение раствора идет и смена его окраски — из малинового раствор становится бесцветным,что объясняется переходом ионов MnO4 — , имеющих малиновую окраску, в практически бесцветный катион марганца Mn 2+ . Эта полуреакция восстановления выражается схемой:
А куда же делся атом кислорода? — обязательно спросит внимательный читатель. В кислой среде атом кислорода, входящий в состав иона, соединяется с атомами водорода, выделяющимися в ходе полуреакции окисления, образуя молекулу воды, при этом, поскольку из одного иона освобождается аж 4 атома кислорода, то для их связывания требуется 8 атомов водорода:
Чтобы уравнять заряды в левой и правой части схемы, в левую часть надо добавить 5 электронов (в левой части сумма зарядов +7, а в левой +2):
Для получения суммарного уравнения реакции, необходимо почленно сложить две полуреакции, предварительно уравняв кол-во отданных и полученных электронов, по аналогии с методом электронного баланса:
Проверяем кол-во атомов и заряды в левой и правой частях суммарного уравнения, они равны, значит уравнение составлено правильно (водорода — по 16 атомов; серы — по 5; марганца — по 2; кислорода — по 8; заряды — по +4).
Чтобы перейти от ионного уравнения к молекулярному, надо в левой части подобрать к катионам и анионам их «пары» — анионы и катионы соответственно, после чего подобранные ионы записать и в правую часть уравнения, после этого ионы объединяются в молекулы, и получается молекулярное уравнение.
Результат аналогичен уравнению, полученному методом электронного баланса.
- Правила составления уравнений ОВР методом полуреакций
- Пример составления уравнения ОВР для кислотной среды
- Пример составления уравнения ОВР для кислотной среды
- Пример составления уравнения ОВР для нейтральной среды
- Фосфин: получение и химические свойства
- Фосфин
- Строение молекулы и физические свойства
- Способы получения фосфина
- Химические свойства фосфина
- Составление уравнений реакций самоокисления-самовосстановления (диспропорционирования)
- 📸 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Правила составления уравнений ОВР методом полуреакций
- На первом этапе в ионном виде записывают полуреакцию окисления и полуреакцию восстановления, в которых указывают вещество-восстановитель и вещество-окислитель, с продуктами их реакции.
- Сильные электролиты записываются в виде ионов.
- Слабые электролиты, газы и твердые вещества, выпадающие в осадок — в виде молекул.
- Продукты реакции между восстановителем и окислителем устанавливаются по справочникам или по «шпаргалке», приведенной на странице «Определение продуктов ОВР» (это самый сложный этап для начинающих).
- Записывают схему реакции, в которой многоточием обозначают неизвестные продукты реакции.
- Что делать с кислородом:
- Если в исходном веществе кислорода содержится больше, чем в продуктах реакции, то «лишний» кислород в растворах с кислой средой связывается с катионами водорода, образуя молекулы воды (O -2 +2H + =H2O); в нейтральных растворах — в гидроксид-ионы: O -2 +H2O=2OH — ;
- Если в исходном веществе кислорода содержится меньше, чем в продуктах реакции, то «недостающий» кислород «забирается» из молекул воды (в растворах с кислой и нейтральной средой): H2O=O -2 +2H + ; в щелочных растворах — за счет гидроксид-ионов: 2OH — =O -2 +H2O.
- В левой и правой частях уравнения должны быть равны суммарное число и знак электрических зарядов.
Достоинства метода полуреакций:
- Работают с реально существующими ионами (MnO4 — ), а не виртуальными (Mn +7 ).
- Нет необходимости знать степени окисления атомов.
- Прослеживается роль среды, в которой происходит взаимодействие веществ.
- Не нужно знать все продукты реакции, они выводятся «сами собой» в процессе составления уравнения.
Пример составления уравнения ОВР для кислотной среды
Составление уравнения реакции серы с азотной кислотой:
- S+HNO3
- S 0 → SO4 2- — процесс окисления восстановителя.
- NO3 — → NO — процесс восстановления окислителя.
- Приводим в «порядок» первую полуреакцию окисления:
- S 0 → SO4 2- — отличник должен здесь спросить, откуда справа взялся кислород? Немного терпения, сейчас все станет ясно.
- в правую часть схемы, где присутствует избыток кислорода, добавляется катион водорода:
S 0 → SO4 2- +H + - у внимательного читателя тут же должен возникнуть вопрос — а откуда взялся катион водорода? Отвечаем: из молекулы воды, которая добавляется в левую часть схемы:
S 0 +H2O → SO4 2- +H + - Вот теперь настало время уравнять в обеих частях схемы кислород, который, теперь понятно, откуда взялся:
S 0 +4H2O → SO4 2- +H + - Теперь надо уравнять водород:
S 0 +4H2O → SO4 2- +8H + - С атомами элементов в обеих частях схемы полный порядок, осталось разобраться с зарядами — в левой части заряд нулевой; в правой: (-2)+8(+1)=+6:
S 0 +4H2O-6e — → SO4 2- +8H +
- Делаем аналогичную работу со второй полуреакцией восстановления:
- NO3 — → NO
- Добавляем водород, в левую часть, где присутствует «лишний» кислород:
NO3 — +H + → NO - В правую часть добавляем воду:
NO3 — +H + → NO+H2O - Уравниваем кислород:
NO3 — +H + → NO+2H2O - Уравниваем водород:
NO3 — +4H + → NO+2H2O - Уравниваем заряды:
NO3 — +4H + +3e — → NO+2H2O
- Уравниваем кол-во электронов, которые были отданы и приняты в двух полуреакциях:
- Суммируем левые и правые части, предварительно умножив на коэффициент (2) члены второй полуреакции:
- Проводим сокращение одинаковых членов в левой и правой частях схемы и добавляем в пару к анионам «нужные» катионы, чтобы образовались молекулы, в нашем случае это будут молекулы азотной и серной кислоты, для этого мы добавим катион водорода (2H + ):
- Суммарное молекулярное уравнение:
S+2HNO3 = H2SO4+2NO — в результате взаимодействия серы с азотной кислотой получается серная кислота и оксид азота (II).
Пример составления уравнения ОВР для кислотной среды
«Фокус» уравнивания кол-ва атомов кислорода и водорода для уравнений ОВР в щелочной среде заключается в следующем:
- Вода (H2O) добавляется в ту часть полуреакции, в которой присутствует избыток кислорода.
- Соответственно, в противоположную часть уравнения-схемы добавляется удвоенное число гидроксид-ионов (OH — ).
- Перед формулой молекулы воды ставится коэффициент, уравнивающий разницу кол-ва атомов кислорода в левой и правой частях полуреакции.
- Перед формулой гидроксид-иона ставится удвоенный коэффициент.
- Восстановитель присоединяет атомы кислорода из гидроксид-ионов.
- MnO2+KClO3+KOH → ?
- MnO2 → MnO4 2- оксид марганца является восстановителем, он будет связывать гидроксид-ионы.
- Поскольку в правой части схемы килорода больше (на 2 атома), то вода добавляется сюда же, перед ее формулой ставится коэффициент 2, соответственно, в левую часть схемы полуреакции добавляют 4 гидроксид-иона:
MnO2+4OH — → MnO4 2- +2H2O - Уравниваем заряды:
MnO2+4OH — -2e — → MnO4 2- +2H2O - ClO3 — → Cl — — полуреакция восстановления.
- Избыток кислорода (3 «лишних» атома) находится в левой части схемы полуреакции, сюда же добавляем и 3 молекулы воды, а в правую часть 6 гидроксид-ионов:
ClO3 — +3H2O → Cl — +6OH — - Уравниваем заряды:
ClO3 — +3H2O+6e — → Cl — +6OH — - Уравниваем в полуреакциях кол-во отданных и принятых электронов (6 и 2 сокращаем на 2), и получаем суммарное уравнение, путем сложения двух уравнений полуреакций:
- Проводим сокращение подобных слагаемых и добавляем катионы калия, чтобы перейти к молекулярной форме уравнения реакции:
- Молекулярное уравнение реакции:
3MnO2+6KOH+KClO3 = 3K2MnO4+3H2O+KCl
Пример составления уравнения ОВР для нейтральной среды
Среду нейтральной можно счситать лишь условно, в любом случае, среда будет либо слабощелочной, либо слабокислотной.
Составляя уравнение ОВР методом полуреакций для нейтральной среды, одну полуреакцию составляют, как для кислотной среды — в левую часть схемы добавляют молекулу воды, в правую — катион водорода), вторую — как для щелочной (в левую часть добавляют молекулу воды, в правую — гидроксид-ион).
- Na2SO3+KMnO4+H2O
- SO3 2- → SO4 2- — процесс окисления восстановителя;
- MnO4 — → MnO2 — процесс восстановления окислителя;
- Схема реакции:
SO3 2- +MnO4 — → SO4 2- +MnO2+. - Составляем уравнения полуреакций:
- Молекулярное уравнение:
Еще один пример:
- S+KMnO4 → ?
- S → SO4 2-
- MnO4 — → MnO2
- Первую полуреакцию оформляем, как для кислотной среды; вторую — как для щелочной:
- Сокращаем обе части равенства на 8 молекул воды, и добавляем катионы калия:
- Молекулярное уравнение:
S+2KMnO4 = K2SO4+2MnO2
Более подробно составление уравнений окислительно-восстановительных реакций методом полуреакций в различных средах рассмотрено на странице Влияние среды на протекание ОВР.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Фосфин: получение и химические свойства
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать

Составление уравнений реакций самоокисления-самовосстановления (диспропорционирования)
Задача 634.
Закончить уравнения реакций самоокисления-самовосстановления (диспропорционирования):
а) I2 + Ba(OH)2 → Ba(IO3)2 +
б) K2SO3 → K2S +
в) HClO3 → ClO2 +
г) P2O3 + H2O → PH3 +
д) P + KOH + H2O → KH2PO2 + PH3
е) Te + KOH → K2TeO3 +
Решение:
Реакции диспропорционирования сопровождаются одновременным увеличением и уменьшением степени окисления одного и того же элемента, первоначально находившихся в одном, определённом состоянии.
а) I 2 + Ba(OH) 2 → Ba(IO 3) 2 +
После приведения членов обеих частей уравнения, получим:
б) K 2SO 3 → K 2S +
После приведения членов обеих частей уравнения, получим:
в) HClO 3 → ClO 2 +
После приведения членов обеих частей уравнения, получим:
г) P2O 3 + H 2 O → PH 3 +
После приведения членов обеих частей уравнения, получим:
д) P + KOH + H 2 O → KH 2 PO 2 + PH 3
После приведения членов обеих частей уравнения, получим:
е) Te + KOH → K 2 TeO 3 +
3Te 0 + 6OH — → TeO3 2- + 2Te 2- + 3H2O.
После приведения членов обеих частей уравнения, получим:
📸 Видео
Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

How to Balance H3PO3 = H3PO4 + PH3 (Decomposition of Phosphorous acid)Скачать

Химические уравнения. Как составлять химические уравнения.Скачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

11 класс.Элементы 4 периода.Электронные формулы.Скачать

СОСТАВНЫЕ УРАВНЕНИЯ / Математика 3 ,4 класс Петерсон , Моро . Как научить решать составные уравненияСкачать

Как строить структурные формулы быстро, как ФЛЭШ — Мое полное РуководствоСкачать

Органическая Химия — ЭТО НУЖНО ВИДЕТЬ! Гибридизация орбиталейСкачать

Урок 4. Расчет цепей постоянного тока. Законы КирхгофаСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

How to Write the for Equation for Zn3(PO4)2 + H2O (Zinc phosphate + Water)Скачать

How to Write the for Equation for Ca3(PO4)2 + H2O (Calcium phosphate + Water)Скачать