1) NH4Br + H2O —> NH4OH + HBr среда кислая
NH4Br —> NH4(+) + Br(-)
H2O H(+) + OH(-)
2) K2CO3 + H2O —> KHCO3 + KOH среда щелочная
K2CO3 —> KCO3(-) + K(+)
H2O H(+) + OH(-)
3) 3MgS + 2H2O —> (MgH)2S3 + Mg(OH)2 среда щелочная (не уверена в правильном составлении формулы кислой соли магния)
MgS —> Mg(2+) + S(2-)
H2O H(+) + OH(-)
4) BaCl2 + H2O —> BaOHCl + HCl среда кислая
BaCl2 —> BaCl(+) + Cl(-)
H2O H(+) + OH(-)
5) Fe(NO3)3 + H2O —> FeOH(NO3)2 + HNO3 среда кислая
Fe(NO3)3 —> Fe(NO3)2(+) + NO3(-)
H2O H(+) + OH(-)
3 и 4 абсолютно не верно! 3 — сульфид магния образован двумя слабыми частицами, плюс в таблице растворимости четкое указание на разложение в водной среде, т. е. можно предположить полный гидролиз! 4 — обе частицы сильные и гидролиз протекать не может!
- Записать уравнение гидролиза следующих солей : BaCl2 , CuCl2 , CO3 , AlPO4?
- Записать уравнение гидролиза соли K2CO3?
- Уравнение гидролиза солей K2SO3?
- 1) Определить, к какому типу солей (по отношению их к гидролизу) относятся следующие соли : хлорид калия, сульфид натрия, нитрат лития, карбонат калия?
- Расскажите , как будет протекать гидролиз следующих солей ?
- Составьте молекулярные и ионные уравнения гидролиза следующих солей : K2SO3 ; NaNO3 ; CuCl2Укажите реакцию среды?
- Напишите уравнение реакций гидролиза солей : K3BO3?
- Написать уравнение гидролиза соли na2sio3?
- Даны соли : карбонат калия, нитрат алюминия, сульфат натрия?
- Напишите уравнения гидролиза следующих солей?
- Cоставить уравнения реакций гидролиза соли по ступеням, укажите среду и рН раствора соли, выведите константу первой ступени гидролиза соли : Na2SO3?
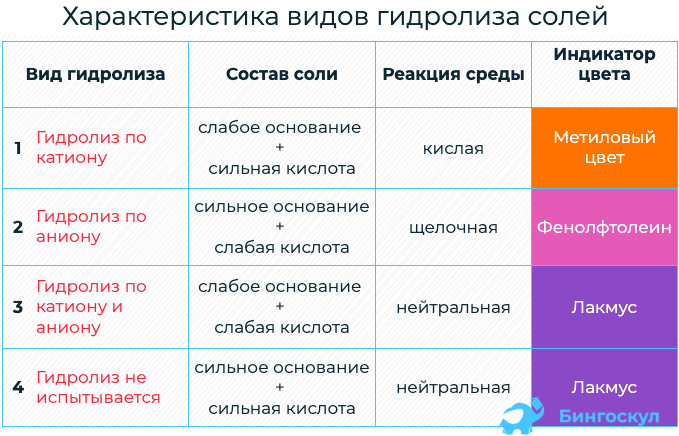
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Содержание:
- Типы гидролиза солей
- 🎬 Видео
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Записать уравнение гидролиза следующих солей : BaCl2 , CuCl2 , CO3 , AlPO4?
Химия | 5 — 9 классы
Записать уравнение гидролиза следующих солей : BaCl2 , CuCl2 , CO3 , AlPO4.
BaCl2 + 2H2O = 2HCl + Ba(OH)2 CuCl2 + H2O = 2HCl + CuOH.
CO3 — это не соль, а оксид (нужно записать уравнение СОЛЕЙ) AlPO4 + 3H2O = H3PO4 + Al(OH)3.
Видео:Гидролиз солей. 9 класс.Скачать

Записать уравнение гидролиза соли K2CO3?
Записать уравнение гидролиза соли K2CO3.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Уравнение гидролиза солей K2SO3?
Уравнение гидролиза солей K2SO3.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

1) Определить, к какому типу солей (по отношению их к гидролизу) относятся следующие соли : хлорид калия, сульфид натрия, нитрат лития, карбонат калия?
1) Определить, к какому типу солей (по отношению их к гидролизу) относятся следующие соли : хлорид калия, сульфид натрия, нитрат лития, карбонат калия.
2) Записать молекулярное и ионное уравнение гидролиза этих солей.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расскажите , как будет протекать гидролиз следующих солей ?
Расскажите , как будет протекать гидролиз следующих солей .
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Составьте молекулярные и ионные уравнения гидролиза следующих солей : K2SO3 ; NaNO3 ; CuCl2Укажите реакцию среды?
Составьте молекулярные и ионные уравнения гидролиза следующих солей : K2SO3 ; NaNO3 ; CuCl2
Укажите реакцию среды.
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Напишите уравнение реакций гидролиза солей : K3BO3?
Напишите уравнение реакций гидролиза солей : K3BO3.
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Написать уравнение гидролиза соли na2sio3?
Написать уравнение гидролиза соли na2sio3.
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Даны соли : карбонат калия, нитрат алюминия, сульфат натрия?
Даны соли : карбонат калия, нитрат алюминия, сульфат натрия.
При гидролизе одной из них среда становится кислой.
Напишите молекулярное и ионное уравнение первой стадии гидролиза этой соли.
Какая из солей не подвергается гидролизу?
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Напишите уравнения гидролиза следующих солей?
Напишите уравнения гидролиза следующих солей.
Видео:Электролиз. 10 класс.Скачать

Cоставить уравнения реакций гидролиза соли по ступеням, укажите среду и рН раствора соли, выведите константу первой ступени гидролиза соли : Na2SO3?
Cоставить уравнения реакций гидролиза соли по ступеням, укажите среду и рН раствора соли, выведите константу первой ступени гидролиза соли : Na2SO3.
На этой странице сайта вы найдете ответы на вопрос Записать уравнение гидролиза следующих солей : BaCl2 , CuCl2 , CO3 , AlPO4?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
1) NaOH + H2 2) ZnS 3) ZnO 4) ZnCl2 + H2 5) ZnCl2 + Fe 6) Mg(OH)2 + H2 7) Mg3P2 8) — 9) MgCl2 10) — 11) MgSO4 + Ni 12) AlBr3 13) Al2(SO4)3 + Fe 14) AlI3 + H2.
FeO + P = Fe + P2O5 1)восстановитель Fe (в степени — 2) – 2е = Fe (в нулевой степени) 2)окислитель Р (в нулевой степени) + 5е = P (в степени + 5).
Химия используется при уборке в доме , мытьё посуды . В сельской хозяйственности для орошения полей от вредителей . В медецине для создания лекарств .
Ba — металлическая BaBr2 — ионная HBr — ковалентная полярная Br2 — ковалентная не полярная.
Ba — металлическая HBr — Ковалентная полярная Br2 — ковалентная не полярная BaBr2 — ионная.
Ми знаємо формулу знаходження масової частки елемента в речовині і у цю формулу підставляємо значення, знаходимо скількі атомів Оксигена у формулі .
В этих местах останутся желтые пятна, а потом они станут оранжевые.
2Al(OH)3 = Al2O3 + 3H2O H2CO3 = CO2 + H2O CACO3 = CAO + CO2( газ) CU(OH)2 = CUO + H2O Zn + 2HCl = ZnCl2 + H°2(газ) Ca° + H2SO4 = CaSO4 + H°2(газ) 3Mg° + 2H3PO4 = Mg3(PO4)2 + H°2(газ) 2Al° + Fe2O3 = Al2O3 + 2Fe° Cu(No3) + NaOH = Cu(OH) (осадок) + NaNo..
2Al(OH)3 — — >Al2O3 + 3H2O H2CO3 — — >CO2 + H2O CaCO3 — — >CaO + CO2 Cu(OH)2 — — >CuO + H2O Zn + 2HCL — — >ZnCL2 + H2 Ca + H2SO4 — — >CaSO4 + H2 3Mg + 2H3PO4 — — >Mg3(PO4)2 + 3H2 2Al + Fe2O3 — — >2Fe + Al2O3 Cu(NO3)2 + 2NaOH — — >Cu(OH)2 + 2NaNO3 HNO..
Вещества : вода, медь Тела : льдина , ваза, труба, гвоздь, сосулька.
Видео:Гидролиз солей.ПримерыСкачать

Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Содержание:
Гидролиз – самый распространенный химический процесс на нашей Земле, определяющий наличие жизни на нашей планете. В результате гидролиза образуются вещества, которые определяют основной химический состав жидкостей во всех живых системах: крови, плазме, тканевой жидкости. Благодаря гидролизу между мембранами клеток функционирует натрий – калиевый насос и регулируется количество основных ионов Na + и K + .
Самый известный на Земле растворитель – вода. Почти все органические и неорганические соединения готовы растворяться в водном растворе.
По химическим свойствам H2O слабый электролит, плохо разлагающийся на ионы. Для водного раствора свойственна нейтральная среда. В данной среде концентрация ионов водорода и гидроксид-ионов равны.
Растворяя всевозможные вещества в воде, возможно получить различные концентрации ионов H + и OH — . Это будет находиться в зависимости от природы вещества и степени его диссоциации.
В зависимости от этого различают слабые и сильные электролиты. К сильным электролитам относятся растворимые соли, кислоты и щелочи.
Соли в водных растворах не просто растворяются, а разлагаются на ионы. Подобный процесс получил название гидролиза.
Состав солей определяется кислотой и основанием, их степенью диссоциации и химическими свойствами. Кислоты и основания могут быть сильными и слабыми.
В зависимости от состава органические вещества относятся к разной степени гидролизуемых веществ: чем выше ионизация в молекуле, тем большему гидролизу подвергается вещество.
Сила электролита
Основание
Кислота
Растворимые основания или щелочи, например:
- гидрооксид натрия – NaOH,
- гидрооксид калия – КОН,
- гидрооксид бария – Ba(OH)2
- и т.д.
- соляная – HCl
- бромоводородная – HBr
- йодоводородная – HI
- азотная — HNO3
- серная – H2SO4
Нерастворимые основания и гидрооксид аммония NH4OH. Hапример:
- гидрооксид алюминия – Al(OH), гидрооксид калия – КОН,
- гидрооксид бария – Ba(OH)2
- и т.д.
- фтороводородная – HF
- сероводородная – H2S
- азотистая – HNO2
- сернистая – H2SO3
- угольная – H2CO3
- ортофосфорная – H3PO4
- кремниевая – H2SiO3
- уксусная – CH3COOH
В зависимости от состава соли определяется тип гидролиза, свойственный для данного вида.
Видео:Химия 8 класс: Гидролиз солейСкачать

Типы гидролиза солей
- Для солей, которые включают слабое основание и сильную кислоту, свойственен гидролиз по катиону.
К примеру CuCl2, — это средняя соль. Состав представлен слабым основанием Cu(OH)2 (нерастворимым в воде) и сильной кислотой HCl.
Все растворимые соли считаются сильными электролитами, вследствие этого при растворении в воде всецело диссоциируют на ионы.
Раствор представляет собой частичную диссоциацию молекулы воды и абсолютное разложение на ионы хлорида меди (II). OH — анионы объединяются с катионом Cu 2+ и образуют нерастворимое соединение, которое не диссоциирует на ионы. Ионы H + и Cl — связываются в молекулу сильного электролита – соляную кислоту. В итоге получается накопление в растворе ионов H + , которые обеспечивают, кислую реакцию среды раствора и изменение цвета индикаторов. Индикатор может быть метиловым оранжевым. В нейтральной среде имеет оранжевый цвет, в кислой окрашивается в красный.
Представляем процесс в виде уравнений реакции:
1) Cu 2+ + H2O = Cu(OH)2 ↓ + 2H + — сокращенное ионное уравнение
2) Cu 2+ + 2Cl — + 2H2O = Cu(OH)2 ↓ + 2H + + 2Cl — — полное ионное уравнение
3) CuCl2 + 2H2O = Cu(OH)2 ↓ + 2HCl— молекулярное уравнение реакции
Для солей, которые включают сильное основание и слабую кислоту, характерен гидролиз по аниону.
К примеру, Na2CO3 представляет собой соль, образованную сильным основанием NaOH (водорастворимым) и слабой кислотой H2CO3.
Когда карбонат натрия растворяется в воде, он полностью распадается на ионы, а молекулы воды отчасти диссоциируют на ионы. В итоге процесса гидролиза ионы Na + и OH — объединяются и получается сильный электролит гидроксид натрия. В растворе накапливается избыточное общее количество гидроксильных анионов OH — , которые свойственны для щелочной реакции среды. Катионы H + и анионы CO3 2- образуют слабую углекислоту, которая в растворе распадается на воду и углекислый газ.
Составляем уравнение гидролиза:
1) CO3 2- + H2O = 2OH — + H2O + CO2 ↑ — сокращенное ионное уравнение
2) 2Na + + CO3 2- + 2H2O = 2Na + + 2OH — + CO2 ↑ — полное ионное уравнение
3) Na2CO3+ 2H2O = 2NaOH + H2CO3 — молекулярное уравнение реакции
Углекислота очень слабая, в растворе распадается на H2O и CO2.
Уравнение будет выглядеть так:
Гидролиз по катиону и аниону характерен для солей, которые состоят из слабого основания и слабой кислоты.
Например, (NH4)2S представляет собой среднюю соль, образованную слабым основанием NH4OH и слабой кислотой H2S.
При растворении сульфида аммония в водном растворе происходит образование малодиссоциирующих веществ-гидроксида аммония и сероводорода. В растворе остаются лишь только молекулы воды, растворная среда станет нейтральной.
Составляем уравнение гидролиза:
1) (NH4)2S + H2O = 2NH3 ↑ + H2O +H2S↑ — молекулярное уравнение реакции
2) Полное и сокращенное ионные уравнения отсутствуют
Гидролизу не подвергается соль, состоящая из сильного основания и сильной кислоты.
Например, BaCl2 представляет собой соль, образованную сильным основанием Ba(OH)2 (водорастворимым) и сильной кислотой HCl.
Представленный тип солей не содержит кислотных остатков и катионов металлов, реагирующих с водой, т. е. способных влиять на РН водного раствора. Консистенции таких солей имеют нейтральную реакционную среду. В процессе растворения в воде образуются сильные электролиты, полностью распадающиеся на ионы.
Процессы диссоциации и гидролиза считаются обратимыми и подчиняются совокупным закономерностям смещения химического равновесия. Данные процессы возможно усиливать и замедлять, добавляя в раствор одноименный ион, разбавляя раствор или же нагревая его.
Для составления уравнений гидролиза солей существует конкретный алгоритм:
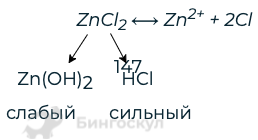
- Запишите формулу соли и определите ее растворимость в воде, применяя таблицу растворимости солей, кислот и оснований в воде.
- ZnCl2 растворимый в воде
- В случае если соль растворима, составьте уравнение диссоциации
- ZnCl2⟷ Zn 2+ + 2Cl —
- Определите состав соли
- Сделайте вывод, какой из ионов соли подвергается гидролизу:
- Zn 2+ — ион, образующий слабый электролит, поэтому он подвергается гидролизу.
В данном случае гидролиз проходит по катиону.
- Zn 2+ + 2H2O = Zn(OH)2↓ +2H +
- В данном случае среда является кислой.
- Zn 2+ + 2Cl — + 2H2O = Zn(OH)2↓ +2H + + 2Cl-
- ZnCl2 + 2H2O = Zn(OH)2↓ + 2HCl
🎬 Видео
Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Гидролиз солей. 10 класс.Скачать

11 класс. Гидролиз солей.Скачать

Константа гидролиза и pH водного раствора солиСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Гидролиз солейСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать