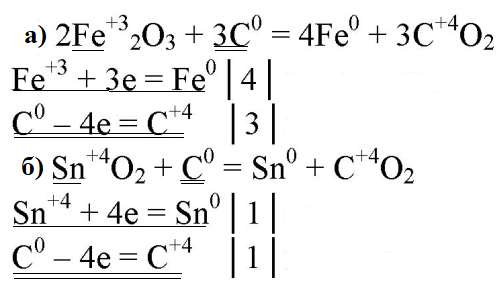- Реакция взаимодействия оксида олова (IV) и углерода
- Реакция взаимодействия карбоната свинца (II) и гидроксида натрия
- Реакция взаимодействия оксида углерода (II) и гидроксида натрия
- Реакция взаимодействия галлия и азотной кислоты
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- Вопросы к параграфу 32 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 32. Химические свойства углерода. Адсорбция
- Вопросы и задания
- 1. При каких процессах образуется древесный уголь? Каково его строение, свойства и применение?
- 2. С помощью каких явлений, которые вы наблюдаете в жизни, можно доказать, что хлеб, молоко, мясо содержат углерод?
- 3. Переведите таблицу 24 в текст.
- 4. Составьте уравнения реакций, протекающих при нагревании угля: 1) с оксидом железа(III); 2) с оксидом олова(IV). Покажите переход электронов и подчеркните одной чертой окислитель, а двумя — восстановитель.
- 5. Основываясь на свойствах углерода и пользуясь рисунком 32, поясните, для каких целей применяют углерод.
- 6. Обсудите с соседом по парте, где в повседневной жизни вы можете встретиться с веществами, в состав которых входят атомы элементов IVA-группы.
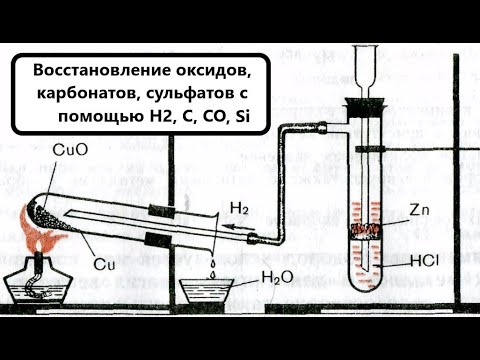
- Восстановление металлов
- Восстановление углеродом или водородом
- Похожие страницы:
- Leave a Comment
- 🎦 Видео
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Реакция взаимодействия оксида олова (IV) и углерода
Уравнение реакции взаимодействия оксида олова (IV) и углерода:
SnO2 + 2C → Sn + 2CO
Реакция взаимодействия оксида олова (IV) и углерода.
В результате реакции образуются олово и оксид углерода (II).
Реакция протекает при условии: при температуре 800-900 °C.
Формула поиска по сайту: SnO2 + 2C → Sn + 2CO.
Реакция взаимодействия карбоната свинца (II) и гидроксида натрия
Реакция взаимодействия оксида углерода (II) и гидроксида натрия
Реакция взаимодействия галлия и азотной кислоты
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Вопросы к параграфу 32 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

§ 32. Химические свойства углерода. Адсорбция
Вопросы и задания
1. При каких процессах образуется древесный уголь? Каково его строение, свойства и применение?
Древесный уголь — твёрдый пористый продукт, разновидность угля, образующийся при нагревании древесины без доступа воздуха. В образовавшемся древесном угле множество капилляров и пор, что делает его хорошим адсорбентом.
Применяют древесный уголь в производстве кристаллического кремния, черных и цветных металлов, сероуглерода, активированного угля, фильтрах для очистки воды, противогазах, как экологически чистое топливо.
2. С помощью каких явлений, которые вы наблюдаете в жизни, можно доказать, что хлеб, молоко, мясо содержат углерод?
Если эти продукты подгорают при жарке, то образуется уголь, значит они содержат углерод.
3. Переведите таблицу 24 в текст.
Кислород легко окисляет углерод до степени окисления +4 с образованием углекислого газа.
В реакциями с оксидами металлов углерод также проявляет свои восстановительные свойства, в результате реакции образуется углекислый газ и металл.
Реакция углерода с углекислым газом и водой приводит к образованию угарного газа.
Углерод может окислять сильные восстановители: металлы — до карбидов, водород — до метана.
4. Составьте уравнения реакций, протекающих при нагревании угля: 1) с оксидом железа(III); 2) с оксидом олова(IV). Покажите переход электронов и подчеркните одной чертой окислитель, а двумя — восстановитель.
5. Основываясь на свойствах углерода и пользуясь рисунком 32, поясните, для каких целей применяют углерод.
- При производстве органических веществ (метанол, бензин, красители);
- В медицине (активированный уголь);
- В ювелирном производстве (алмазы);
- В производстве полимеров (резина).
6. Обсудите с соседом по парте, где в повседневной жизни вы можете встретиться с веществами, в состав которых входят атомы элементов IVA-группы.
В повседневной жизни мы постоянно сталкиваемся с объектами, в составе которых присутствует углерод. Например:
— в изделия из резины и пластика – (игрушки, бытовая техника, одежда и т.д.) — в составе полимеров;
— NaHCO3 – пищевая сода; CaCO3 – мел, мрамор, известняк — в виде карбонатов;
— в еде, лекарственных средствах, красителях и т.д. — в виде органических веществ.
В форме SiO2 – песока — кремний наиболее распространён; его формы также входят в состав стекла и разнообразных минералов. Кремний применяется также в составе полупроводников в бытовой электронике.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Восстановление металлов
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Восстановление углеродом или водородом
Водород для восстановления окислов применяют реже, он дороже и взрывоопасен, но необходим в тех случаях, когда уг лерод может образовать с металлами иногда нежелательные карбиды, например при восстановлении вольфрама и молибдена:
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
🎦 Видео
Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Получение металлов. 9 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

способы получения металловСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Составление формулы оксидов. ПримерСкачать

Оксиды металловСкачать

Свойства металлов. РЕАКЦИИ металлов. ЕГЭ по Химии. Таисия Фламель. ВебиумСкачать

Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

Решение цепочек превращений по химииСкачать