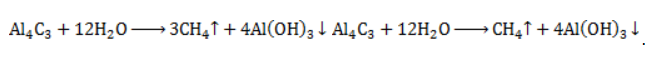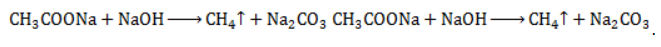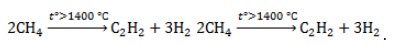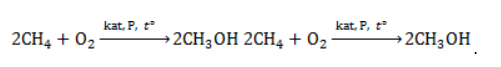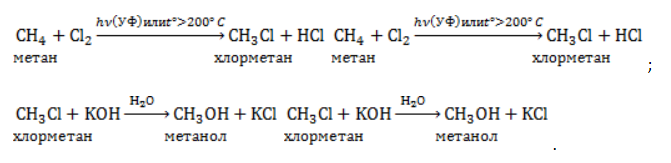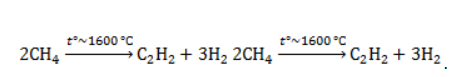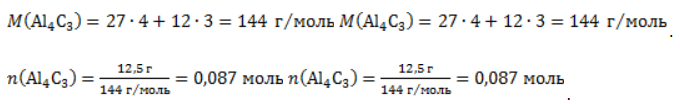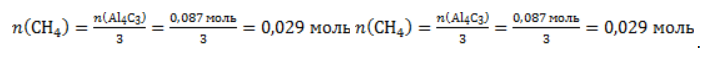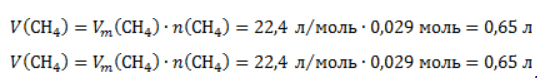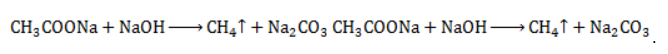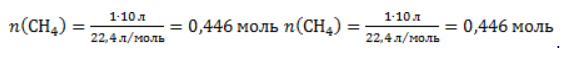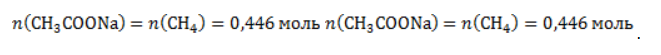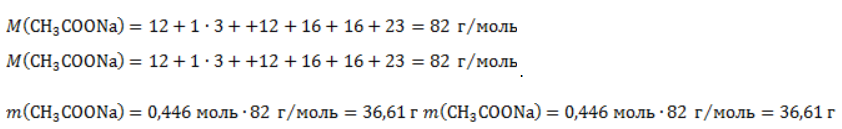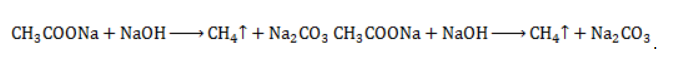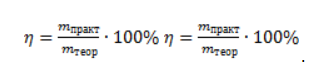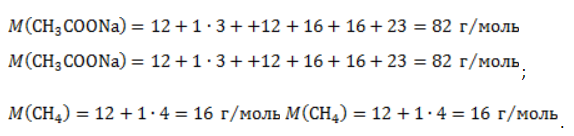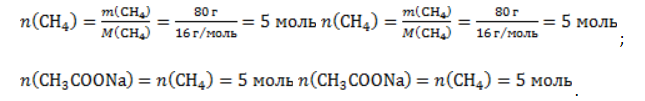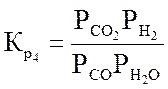Простейшее углеводородное соединение – метан – используется в промышленности, на транспорте, в быту, находя широкое применение и как сырье для органического синтеза, и в качестве конечного продукта. Потребность в метане испытывают многие отрасли хозяйства, и его производство постоянно расширяется.
- Общая характеристика метана
- Физические свойства
- Получение метана
- Промышленные методы получения метана
- Очистка и переработка природного газа
- Переработка нефти и попутного газа
- Переработка каменного угля
- Лабораторный синтез метана
- Взаимодействие карбида алюминия с водой (метод Муассана)
- Взаимодействие ацетата натрия с щелочью (метод Дюма)
- Получение метана в домашних условиях
- Получение из органических отходов животноводства
- Получение из древесины
- Эффективность синтеза биометана
- Метан в органическом синтезе
- Получение ацетилена из метана
- Получение метанола из метана
- Получение анилина из метана
- Заключение
- Примеры решения задач
- Процесс конверсии метан и его гомологов
- Страницы работы
- Содержание работы
- Лабораторная работа по химии на тему: «Получение метана и изучение его свойств»
- 🌟 Видео
Видео:Реакция Дюма. Получение метанаСкачать

Общая характеристика метана
Метан представляет собой легкий бесцветный горючий газ без запаха. Распространен в природе как основной компонент природного газа и попутных нефтяных газов. Химическая формула – 
В атмосферу метан поступает в составе вулканических газов, а также является продуктом жизнедеятельности ряда микроорганизмов. В форме газогидратов в значительных количествах содержится на дне океанов и в многолетней мерзлоте. Является одним из важнейших парниковых газов.
Как представитель ряда предельных углеводородов проявляет низкую химическую активность. Вследствие малой растворимости в воде и химической инертности метан считается малотоксичным веществом (класс опасности – IV), но при высокой концентрации в воздухе (4,4 — 17%) взрывоопасен, а дальнейшее повышение содержания метана приводит к удушью от недостатка кислорода.
Физические свойства
Основные физические характеристики метана при нормальном атмосферном давлении приведены в таблице.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Получение метана
Промышленное производство и получение метана в лаборатории проводятся разными методами. Существуют также способы получения газа в домашних условиях, например, в частном хозяйстве для удовлетворения потребности в топливе.
Промышленные методы получения метана
Поскольку газ в больших количествах поступает при добыче нефтегазового сырья, способы его производства нацелены не на искусственный синтез, а на выделение в процессах переработки нефти и газа. Кроме того, метан может быть получен при технологической обработке каменноугольного сырья.
Очистка и переработка природного газа
Метан – главный компонент такого важного вида горючих полезных ископаемых, как природный газ. Содержание метана в газе различных месторождений составляет 70-98%.
После очистки от твердых частиц и примесей (сероводород, азот, углекислый газ, гелий) и осушки (отделения водяных паров) природный газ подвергается низкотемпературному фракционированию. Более тяжелые углеводородные компоненты газа – этан, пропан и бутан – переходят в жидкую фазу при более высоких температурах, чем метан, и последовательно отделяются от него в конденсационной колонне.
Переработка нефти и попутного газа
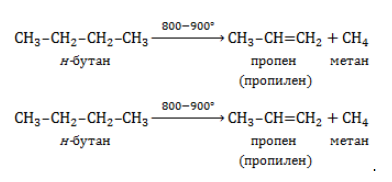
В процессах термического разложения (пиролиза) высокомолекулярных алканов, входящих в состав нефти, в числе продуктов получают метан:
Метан входит в состав газа, отделяемого от сырой нефти в процессе крекинга (разложения при высоком давлении и температурах около 450 — 550 ℃ либо с использованием катализатора). Кроме того, метан составляет значительную долю попутных газов, от которых его отделяют методом сепарации.
Переработка каменного угля
- Коксование угля. Большое количество метана (в среднем 34%) содержится в коксовом газе, образующемся при термической переработке угольного сырья. В числе прочих углеводородов метан отделяется от шихты при .
- Гидрирование угля. Метан образуется при обработке угольной массы водородом (ожижение угля с целью получения жидкого топлива). Реакции идут на металлическом катализаторе:
Лабораторный синтез метана
В лабораторной практике используются два основных способа получения метана:
- гидролиз карбида алюминия;
- щелочное плавление ацетата натрия.
Взаимодействие карбида алюминия с водой (метод Муассана)
Неорганическое бинарное соединение 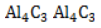
Реакция необратима и служит простым и удобным способом получения газа в лабораторных условиях.
Взаимодействие ацетата натрия с щелочью (метод Дюма)
Еще один простой лабораторный способ получения метана – прокаливание натриевой соли уксусной кислоты 

Подробное рассмотрение лабораторного процесса показывает, как с помощью щелочи получить метан из ацетата натрия.
Присутствие воды препятствует этой реакции, поэтому уксуснокислый натрий должен быть обезвожен, а гигроскопичный гидроксид натрия – смешан с негашеной известью (оксидом кальция). Такая смесь носит название натронной извести. В реакционной смеси она должна присутствовать с избытком 1:3, чтобы обеспечить полное использование ацетата натрия.
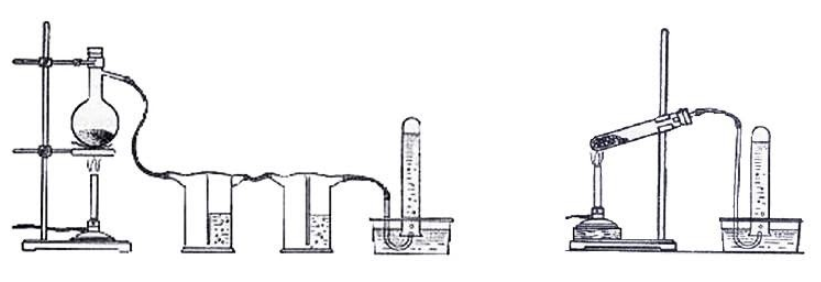
Порошки реагентов хорошо перемешиваются и помещаются в колбу с отводной трубкой или в пробирку. Выделяющийся газ собирают по методу вытеснения воды в пробирку. При нагревании колбы на пламени горелки используется асбестовая сетка. Пробирку нагревают на открытом пламени. Для улавливания примесей может использоваться промывная склянка с раствором щелочи. Для проверки результата опыта газ в пробирке поджигается.
Варианты сборки прибора для получения метана в лаборатории изображены на рисунке.
Получение метана в домашних условиях
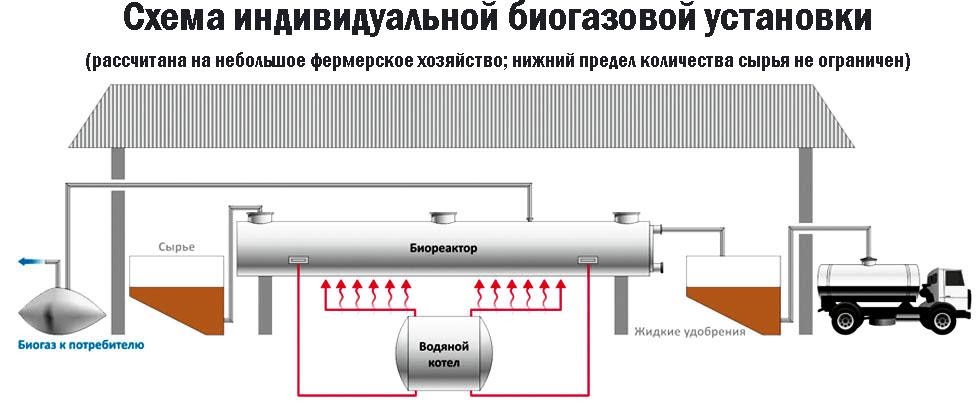
Метан можно получать и как продукт биологических процессов. Он выделяется в ходе обмена веществ особыми анаэробными микроорганизмами – бактериями-метаногенами. Они широко распространены в органических отходах животного и растительного происхождения.
Поскольку метан может применяться в качестве горючего для водонагревательных установок, печей и кухонного оборудования, в частных хозяйствах, располагающих большим количеством отходов, становится выгодным самостоятельное получение из них метана и его использование.
Получение из органических отходов животноводства
Метаногены обитают в кишечном тракте позвоночных и принимают участие в пищеварительном процессе. Поэтому в хозяйствах, занимающихся разведением крупного рогатого скота, свиней или домашней птицы, отходы жизнедеятельности животных могут быть переработаны с помощью биогазовых установок. Неразложимый остаток служит органическим удобрением.
Технология получения биогенного метана состоит из нескольких этапов:
- анаэробное брожение биомассы в специальном резервуаре – ферментере, или биореакторе, с соблюдением температурного режима;
- отвод выделяющейся газовой смеси, в которой доля метана составляет до 70%;
- транспортировка биогаза к оборудованию-потребителю;
- регулярная выгрузка отработанной массы и загрузка биореактора новым сырьем.
В некоторых установках предусмотрена система очистки биогаза от примесей – углекислого газа и сероводорода.
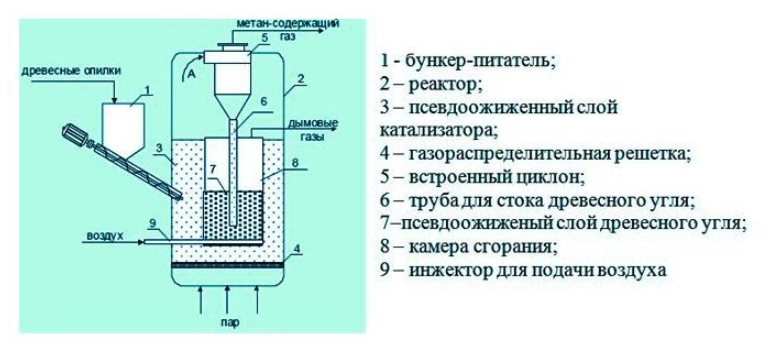
Получение из древесины
В качестве сырья для биогазовой технологии могут использоваться и растительные отходы, такие как древесная щепа. Пригодна для использования в биореакторе некондиционная древесина (например, пораженная вредителями или пострадавшая от пожаров), а также отходы лесозаготовок – ветки, кора и пр.
Так как древесина содержит смолы, в установках по ее переработке нужно применять катализаторы для очистки газа. В качестве катализатора подходят шлаки металлургических производств, особенно эффективны мартеновские шлаки.
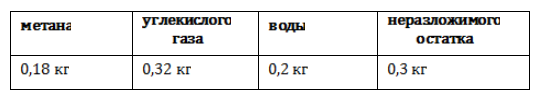
Эффективность синтеза биометана
В среднем переработка 1 кг биомассы, разложимой на 70%, дает:
Эффективность выработки биогаза зависит от поддержания нужной температуры ферментации, поэтому в холодных регионах работа биогазовой установки потребует дополнительных затрат на подогрев и устройство надежной теплоизоляции. Большую роль играет биохимическое равновесие: выход газа снижается при возрастании кислотности. В этом случае требуется добавление нейтрализующего агента.
Крупные фермерские хозяйства могут позволить себе привлечение специалистов, установку полностью автоматизированных биореакторов с большим выходом газа и получать дополнительный доход от его продажи.
Для эффективной работы установки необходимо бесперебойное поступление сырья, поэтому хозяйствам с малым количеством животных невыгодно заниматься производством биометана. Если количество биомассы позволяет наладить синтез газа в небольшом хозяйстве, мини-установку для его производства можно сделать собственными силами. Следует помнить, что ее сооружение потребует серьезных вложений, составления технологической схемы, оформления документации, согласования с СЭС, пожарной и газовой инспекциями.
Если хозяйство имеет возможность установить биогазовый реактор, оно получает существенные выгоды:
- экономия при затратах на энергию;
- производство удобрения;
- ликвидация отходов и оздоровление экологической обстановки на участке.
Видео:Получение метанаСкачать

Метан в органическом синтезе
Метан широко используется для получения многих востребованных соединений, таких как ацетилен, метанол или анилин.
Получение ацетилена из метана
В лабораторной практике проводится дегидрирование метана. Реакция требует сильного нагревания:
В промышленности используются такие методы, как:
- Окислительный пиролиз (Заксе-процесс):
В этой реакции используется теплота частичного сгорания сырья, благодаря которой реакционная смесь разогревается до 1600 ℃ .
Получение метанола из метана
Метиловый спирт может быть получен:
- Каталитическим окислением метана:
- Двухступенчатым процессом, в ходе которого сначала получают хлорпроизводное метана, которое затем подвергается щелочному гидролизу:
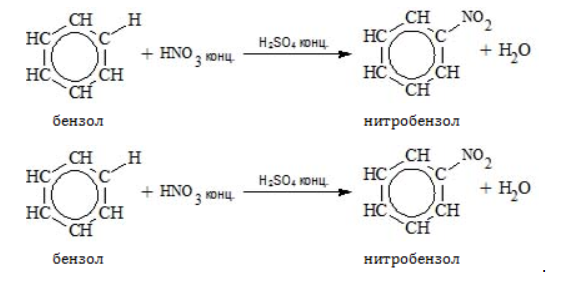
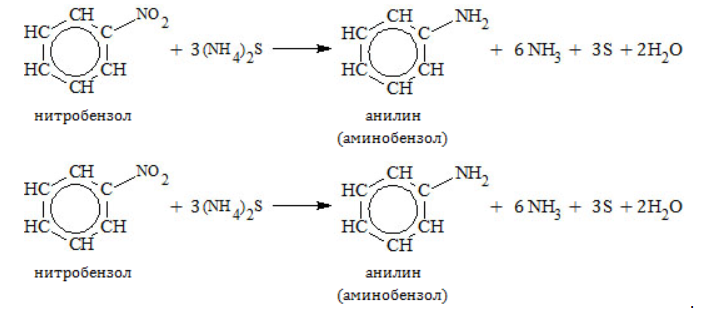
Получение анилина из метана
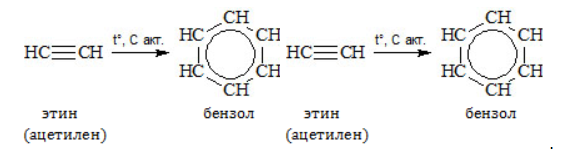
Ароматическое соединение анилин получают в несколько стадий:
- Крекинг метана:
- Тримеризация ацетилена:
- Нитрование бензола:
- Восстановление нитробензола:
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Заключение
Метан востребован во многих областях. Росту объемов его производства для различных нужд способствует достаточно высокая распространенность в природе. Однако метан производится не только на крупных промышленных предприятиях. Простота его получения с использованием биологических отходов стимулирует производство индивидуальными хозяйствами, что идет на пользу экологической обстановке, снижая бесконтрольное гниение отходов и выброс ценного продукта в атмосферу.
Видео:Изомеры, гомологи, органическая химияСкачать

Примеры решения задач
1. Каков объем метана, выделяющегося при гидролизе карбида алюминия массой 12.5 г.?
Запишем уравнение реакции:
Найдем количество карбида алюминия, вступающего в реакцию, по формуле 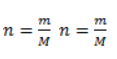
Из уравнения реакции видно, что 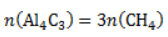
Молярный объем газа Vm при нормальных условиях составляет 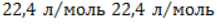
2. Какова масса ацетата натрия, необходимого для получения 10 л метана?
Запишем уравнение реакции:
Используя знание молярного объема газа, составим пропорцию:
Вычислим количество получаемого метана:
Из него следует, что количество ацетата натрия равно количеству метана:
Рассчитаем массу ацетата натрия по формуле m=nM.
3. Сколько граммов ацетата натрия затрачено на получение 60 г метана при выходе продукта реакции 75%?
Запишем уравнение реакции:
Выход продукта равен отношению массы вещества, полученной на практике, к массе, рассчитанной по уравнению:
Вычислим расчетную массу метана:
Рассчитаем молярные массы ацетата натрия и метана:
Уравнение показывает, что количества вещества ацетата натрия и метана равны. Вычислим их:
Вычислим массу ацетата натрия:
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Процесс конверсии метан и его гомологов
Страницы работы
Содержание работы
3. Технологическая часть
3.1. Теоретические основы процесса
В настоящее время конверсия метана и его гомологов является основным промышленным методом получения водорода и технологических газов для синтеза аммиака, спиртов, моторных топлив и других продуктов.
В процессе конверсии метан окисляется водяным паром, диоксидом углерода или кислородом по следующим основным реакциям:
Реакции окисления гомологов метана протекают аналогично. Так, взаимодействие их с водяным паром может быть в общем виде выражено уравнением:
СnНm + nН2O = nСО + 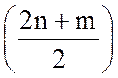
При получении азотоводородной смеси для синтеза аммиака необходимое количество азота вводят с воздухом на стадии конверсии углеводородных газов либо при промывке конвертированного газа жидким азотом для удаления остатков оксида углерода.
Для проведения в промышленных условиях сильно эндотермических реакций (3.1) и (3.2) требуется подвод тепла извне. При добавлении кислорода протекает экзотермическая реакция (3.3), что позволяет осуществить процесс конверсии углеводородных газов автотермично [ 2].
Термодинамическое равновесие конверсии метана
Ниже даны выражения констант равновесия реакций (3.1)-(3.4).
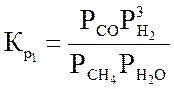
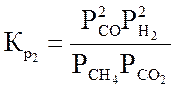
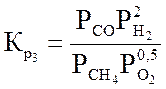
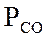
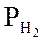
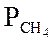
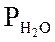
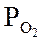
Состав конвертированного газа определяется положением равновесия независимых реакций (3.1) и (3.4).
Реакция (3.2) является производной, а реакцией (3.3) можно пренебречь, так как константа ее равновесия, в интервале температур 327-1127 °С настолько велика, что концентрация непрореагировавшего кислорода в равновесной газовой смеси практически равна нулю.
В расчетах принимается, что все газы являются идеальными, а добавляемый кислород реагирует с водородом с образованием водяного пара.
Зависимости констант равновесия от температуры (Т в К) могут быть представлены в виде полиномов [1]:
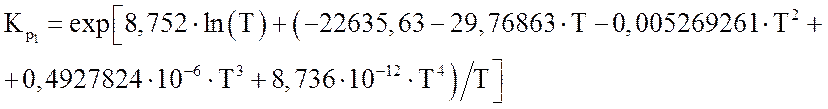
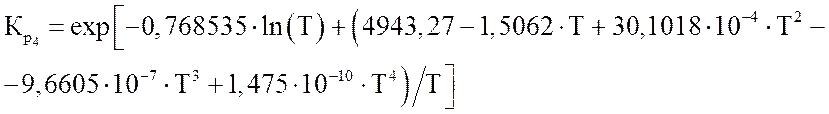
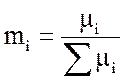
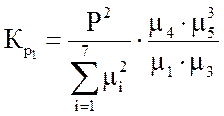
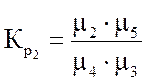
где m – мольные доли компонентов; 1 – СН4; 2 – СО2; 3 – Н2О; 4 – СО; 5 – Н2.
На основе известных методик через мольные доли всех компонентов, участвующих в реакциях (3.1) и (3.4), ведут расчет равновесных составов конвертированного газа при различных значениях давления (в МПа), соотношениях пар:газ и температурах реакций. На основе расчетного массива данных строят номограммы зависимости содержания отдельных компонентов в конвертированном газе [1, 2].
Ниже приведены реакции взаимодействия некоторых высших алифатических углеводородов с водяным паром и гидрирования их с образованием метана:
Численные значения констант равновесия реакций (3.9)-(3.12) в интервале температур 327-827 °С намного выше констант равновесия реакций конверсии метана водяным паром (3.5). Как показали термодинамические расчеты, при добавлении водяного пара в двукратном количественно сравнению со стехиометрическим) гомологи метана и олефины практически полностью конвертируются при 400-500 °С. Однако реакция (3.1) при этих температурах в значительной мере протекает справа налево с синтезом метана из СО и Н2, образовавшихся по реакциям (3.9)-(3.12) [1].
Метан образуется также в результате гидрирования высших алифатических углеводородов по реакциям (3.13) и (3.14). Показано, что на промышленном никелевом катализаторе ГИАП-3 при небольшом (по сравнению со стехиометрическим количеством) избытке водорода, температуре около 400 °С и времени контакта 0,5-1 с технический пропан, н-гексан и этилен практически нацело превращаются в метан. При гидрировании этилена вначале образуется этан, а затем метан 2.
При конверсии этана, пропана, бутана и олефинов водяным паром на никелевом катализаторе при температуре 600 °С и выше в продуктах реакции из углеводородов был обнаружен только метан. Поэтому равновесный состав газа, получаемого конверсией любых алифатических углеводородов при указанной температуре, можно определить, исходя только из констант равновесия реакций (3.1) и (3.4).
По разработанной методике содержание углеводородов в исходном газе следует при этом выразить эквивалентным количеством метана и учесть расход водорода на гидрирование высших углеводородов.
Двухступенчатая паровая и паровоздушная конверсия метана
Обычная схема. Результаты проведенных термодинамических расчетов процесса паровой и парокислородной конверсии метана рассматривались самостоятельно без учета возможности получения комплексных уравнений [1].
При осуществлении последовательного двухступенчатого процесса, в котором на первой ступени (трубчатая конверсия) протекает паровая конверсия, а на второй паровоздушная (шахтная доконверсия) состав конвертированного газа на выходе из шахтного конвертора определяется составом, давлением и температурой конвертированного газа на выходе из трубчатой печи, который перед шахтным конвертором смешивают с воздухом.
Расчет состава продуктов реакции после трубчатых печей и шахтного конвертора проводят по уравнениям двух основных реакций (3.1) и (3.4) и уравнению теплового баланса шахтного конвертора 3.
Для расчета следует задать: остаточное содержание метана в сухом газе; соотношение (Н2+СО):N2 по объему; температуре реакционной смеси на выходе из трубчатой печи; потери тепла в шахтном конверторе и потери тепла в трубопроводе между трубчатой печью и шахтным конвертором.
При расчете определяют: состав конвертированного газа; соотношение пар:газ на входе в трубчатую печь; температуру конвертированного газа после шахтного конвертора и соотношение природный газ : технологический воздух 5.
Согласно методике расчета 2-ступенчатой конверсии вначале определяют состав исходной парогазовой смеси с учетом добавления азотоводородной смеси и реакций гидрирования высших углеводородов. Затем для заданной равновесной температуры на выходе из стадии паровой конверсию рассчитывают состав конвертированного газа из условий равновесия по ранее описанной методике. Константы равновесия реакций конверсии газа определяют по уравнениям (3.5) и (3.6), тепло, подводимое к реакционным трубам, – из разности энтальпий компонентов на выходе из реактора и на входе в него.
При определении параметров работы шахтного конвертора рассчитывают состав и температуру газа на выходе из него. Задавая температуру газа на выходе из шахтного конвертора, находят состав газа. После этого проверяют сходимость теплового баланса. В этом случае теплосодержание смеси газов на входе в шахтный конвертор должно равняться сумме теплосодержаний компонентов смеси на выходе и тепловых потерь [1].
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Лабораторная работа по химии на тему: «Получение метана и изучение его свойств»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Лабораторная работа № 8
«Получение метана и изучение его свойств»
Цель работы: освоить лабораторный способ получения метана и изучить его свойства.
Техника безопасности при выполнении опытов:
1. Соблюдать правила работы со стеклянной посудой, спиртовками;
2. Особо осторожно обращаться с легковоспламеняющимися жидкостями.
3. Поджигать метан после установления устойчивого синхронного пробулькивания газа в растворах, но не в первые минуты прохождения метана.
 |
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи.
Метан – первый представитель ряда алканов с формулой СН4. Это бесцветный природный газ без запаха. Метан используется в качестве топлива. При высокой температуре самовоспламеняется. Газ подвержен нитрованию, галогенированию, сульфохлорированию, окислению под действием катализатора, водяного пара, горения, а также крекингу, используемого в переработке нефти.

- легче воздуха;
- без запаха и вкуса;
- плохо растворяется в воде;
- молекулярная масса – 16;
- температура плавления – -182,49°С;
- температура кипения – -161,56°С;
- температура вспышки – -188°С;
- температура самовоспламенения – 537,8°С.
1) Изучите химические и физические свойства метана.
! Проверьте наличие реактивов и оборудования на своих рабочих местах.
Реактивы и оборудование: штатив, пробирка, спиртовка, газоотводная трубка, кристаллизатор, цилиндр, ацетат натрия, гидроксид натрия, раствор перманганата калия, бромная вода.

В пробирку поместите равное количество порошков ацетата и гидроксида натрия (рис. 1). Пробирку закройте пробкой с газоотводной трубкой и закрепите на штативе. Сильно нагревая пробирку со смесью, соберите газ методом вытеснения воды в другую пробирку. Образующийся метан используйте для изучения его физических свойств.
1. Составьте уравнение реакции получения метана.
Опыт №2. Горение метана и изучение его физических свойств.
Заполните метаном цилиндр. Обратите внимание на агрегатное состояние метана, цвет, растворимость в воде. Подожгите выделяющийся газ.
1. Сделайте заключение об агрегатном состоянии метана, определите цвет, растворимость в воде.
2. Каким пламенем горит метан? Почему? Какие соединения образуются при горении метана? Напишите уравнение реакции горения метана .
Опыт 3. Отношение метана к раствору перманганата калия и бромной воде.
Пропустите метан через раствор перманганата калия и бромной воды.
1. Как изменяется окраска раствора перманганата калия и бромной воды при пропускании через них метана? Сделайте вывод об отношении метана к окислителям.
2. Сделайте вывод о реакционной способности метана и предельных углеводородов в целом.
Сделайте вывод о свойствах метана.
!После окончания работы приведите в порядок рабочее место.

1. К какому гомологическому ряду относится метан?
2. Какие лабораторные способы получения метана вы знаете?
После выполнения лабораторной работы студент должен уметь:
1. составлять структурные формулы предельных углеводородов;
2. называть предельные углеводороды по номенклатуре ИЮПАК;
3. составлять уравнение химических реакций предельных углеводородов.
После выполнения лабораторной работы студент должен знать :
1. строение молекулы метана;
2. химические и физические свойства метана;
3. отношение метана к окислителям.
1. Оформить отчет по лабораторной работе.
2. Ответьте на вопросы:
А) Где и в каком виде метан встречается в природе?
Б) Как опытным путём можно отличить метан от водорода?
В) Как в промышленности из метана получают синтез-газ? Составьте уравнения соответствующих химических реакций.
🌟 Видео
Уравнивание реакций горения углеводородовСкачать

МЕТАН ШКОЛЬНИКУ - РАЗОБЛАЧЕНИЕ | КУРС МЕТАНА ДЛЯ НАЧИНАЮЩИХ | МЕТАНДРОСТЕНОЛОН | ДАНАБОЛ (new)Скачать

Упражнения на составление формул и названий гомологов и изомеров | Химия 10 класс #5 | ИнфоурокСкачать

ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать

1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать

Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

СЕКРЕТЫ АЛКАНОВ РАСКРЫТЫ — Гомологи, Типы Связей, ИзомерияСкачать

Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать

Видео №3. Как составить изомерыСкачать