OBRAZOVALKA.COM — образовательный портал
Наш сайт это площадка для образовательных консультаций, вопросов и ответов для школьников и студентов .
На вопросы могут отвечать также любые пользователи, в том числе и педагоги.
Консультацию по вопросам и домашним заданиям может получить любой школьник или студент.
- Жесткое окисление алкенов. Как записать уравнение?
- Жесткое окисление алкенов в кислой среде
- Пропен + KMnO4 +H2SO4
- 2-метилпропен + KMnO4 + H2SO4
- Пропен + K2Cr2O7 + H2SO4
- 2-метилпропен + K2Cr2O7 + H2SO4
- 2 — метилпропен — 1 + kmno4 + h2so4 (электронный баланс)?
- FeSO₄ + KMnO₄ — — [H⁺] — — — > ; / Fe³⁺ / методом электронного баланса?
- Составить электронный баланс?
- Как решать уравнения электронного баланса?
- Карбид алюминия электронный баланс?
- Электронный баланс fe + Hcl?
- Химия?
- Электронный баланс S + H2?
- Срочно ?
- Подвести электронный баланс?
- Электронный баланс Mg + HCL?
- Acetyl
- 🎥 Видео
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

Жесткое окисление алкенов. Как записать уравнение?
Видео:ОВР с перманганатом калия.Скачать
Жесткое окисление алкенов в кислой среде
Данный процесс чаще всего осуществляют, действуя на алкены подкисленным раствором перманганата калия, либо дихромата калия. В качестве средообразователя всегда используют серную кислоту. При таком окислении происходит полный разрыв углеродного скелета по двойной связи, и в зависимости от особенностей строения продуктами окисления могут быть различные вещества.
Давайте сначала разберемся с тем, какие углеродсодержащие продукты образуются при жестком окислении алкенов с различным строением. Представим, что у нас стоит задача определить продукты окисления для следующих двух веществ:
Обратите внимание, что углеродные атомы при двойной связи обозначены разными цветами.
Атом углерода, выделенный красным цветом, является первичным, то есть связан только с одним другим атомом углерода.
Атом углерода, выделенный желтым цветом, является вторичным, то есть связан с двумя другими атомами углерода.
Атом углерода, выделенный зеленым цветом, является третичным, то есть связан с тремя другими атомами углерода.
Жесткое окисление подразумевает разрыв углеродного скелета по месту двойной связи:
Следует запомнить, что первичные атомы углерода (красные) при таком окислении переходят в углекислый газ.
Вторичные атомы углерода (желтые) переходят в состав карбоксильной группы (COOH), то есть образуется карбоновая кислота.
Третичные атомы углерода(зеленые) переходят в состав карбонильной группы, то есть образуется кетон.
Теперь осталось разобраться с остальными продуктами реакции. Если в качестве окислителя используется сернокислый раствор перманганата калия, то продуктами будут также MnSO4, K2SO4 и H2O. Если же в качестве окислителя взяли сернокислый раствор дихромата калия, продуктами будут Cr2(SO4)3, K2SO4 и H2O.
Давайте разберем все эти случаи. Начнем с реакции пропена с сернокислым раствором перманганата калия.
Пропен + KMnO4 +H2SO4
Исходя из вышесказанного, запишем схему этой реакции:
Осталось расставить коэффициенты. Определим, какие атомы изменили степени окисления. В случае марганца ничего сложного нет: степень окисления его в перманганате была +7, стала равна +2. Также степени окисления меняют те атомы углерода, у которых изменилось окружение. В схеме эти атомы обозначены желтым и красным цветами. Определим степени окисления этих атомов методом блоков. Изолируем друг от друга фрагменты молекулы по углерод-углеродным связям следующим образом:
Далее, условно примем, что заряд каждого выделенного блока равен нулю (как у нейтральной молекулы). Степень окисления водорода в органических веществах всегда равна +1. Обозначим степени окисления «желтого» атома С как х, «красного» — как y:
Далее, учитывая, что заряд каждого блока мы приняли равным нулю, мы можем составить и решить два уравнения:
Аналогично рассчитаем степень окисления «желтого» атома углерода в уксусной кислоте и «красного» в молекуле углекислого газа, учитывая, что степень окисления кислорода в органических веществах всегда равна -2 (кроме органических пероксидов, изучение которых в не входит в программу ЕГЭ):
Далее, аналогично, составим и решим два уравнения, учитывая, что заряд выделенного блока мы приняли равным нулю, а заряд молекулы углекислого газа, как и у любой другой молекулы, также нейтрален.
Таким образом, «желтый» атом углерода имел степень окисления до реакции, равную -1, а после +3.
«Красный» атом углерода изменил свою степень окисления с -2, на +4.
Учитывая, что марганец изменил свою степень окисления с +7 на +2, еще раз запишем схему реакции и составим электронный баланс. «Желтый» и «красный» атомы углерода, очевидно, всегда будут в соотношении 1 к 1, независимо от коэффициента перед органическим веществом, потому запишем их в одной строчке «полуреакции» окисления.
Перенесем коэффициенты из баланса:
Поскольку в левой части схемы мы видим два атома калия, в правой части схемы перед сульфатом калия коэффициент 1, ставить который не нужно. В правой части уравнения мы видим 3 сульфатных остатка, поэтому ставим перед серной кислотой коэффициент 3:
Осталось поставить коэффициент перед водой в правой части. Это можно сделать по кислороду или водороду на выбор. Поскольку мы уравняли число сульфатных остатков в левой и правой частях, то кислород в них можно не учитывать. Считаем только кислород в остальных соединениях. Слева мы видим 8 атомов кислорода (не считая кислород в серной кислоте). В правой части не считая воду — 4 атома кислорода. Поэтому перед водой коэффициент будет равен 4:
Сравнивая количества всех элементов слева и справа, видим, что все коэффициенты расставлены верно.
2-метилпропен + KMnO4 + H2SO4
Аналогично предыдущему примеру рассчитаем степени окисления углеродных атомов, которые изменили свою степень окисления:
Учитывая, что заряд каждого выделенного блока мы приняли равным нулю, составим и решим уравнения:
Аналогично поступим с продуктами окисления:
составим и решим уравнения:
Таким образом, «зеленый» атом углерода до реакции имел степень окисления, равную 0, после +2, «красный» изменил свою степень окисления с -2 на +4.
Далее запишем схему окисления и составим электронный баланс:
Перенесем коэффициенты из электронного баланса в схему:
Далее мы видим, что в левой части схемы 8 атомов калия, потому перед сульфатом калия поставим коэффициент 4.
Теперь можно заметить, что в правой части уравнения 12 сульфатных групп (8 в сульфате марганца, 4 в сульфате калия). Поэтому перед серной кислотой в левой части нужно поставить коэффициент 12:
Осталось поставить коэффициент перед водой. Сделаем это по кислороду. Количество сульфатных групп мы уравняли, потому кислород в них можно не учитывать. Слева мы видим 32 атома кислорода (8*4). В правой части уравнения, не считая воды и сульфатных групп, 15 атомов кислорода (5 в молекуле кетона и 10 в 5 молекулах углекислого газа). Таким образом, перед водой необходимо поставить коэффициент 17.
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
Пропен + K2Cr2O7 + H2SO4
Состав продуктов будет точно таким же, как и в случае окисления перманганатом, за исключением того, что вместо сульфата марганца (II) образуется сульфат хрома (III). Запишем схему реакции и составим электронный баланс.
Перенесем коэффициенты из баланса в схему:
Далее уравняем калий, поставив коэффициент 5 перед сульфатом калия:
В правой части мы видим 20 сульфатных групп. Следовательно, перед формулой серной кислоты нужно поставить коэффициент 20:
Осталось поставить последний коэффициент перед формулой воды. Сделаем это, как и в двух предыдущих случаях, по кислороду, не считая кислород в сульфатных группах, поскольку их количества уравнены. В левой части мы видим 35 атомов кислорода. В правой части, не считая воды, 12 атомов кислорода (6 в трех молекулах CH3COOH и 6 в трех молекулах CO2). Таким образом, перед формулой воды нужно поставить коэффициент 23:
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
2-метилпропен + K2Cr2O7 + H2SO4
Запишем схему реакции и электронный баланс:
Перенесем коэффициенты из баланса в схему:
Перед сульфатом калия поставим коэффициент 4, чтобы уравнять количества атомов калия в левой и правой частях схемы:
Перед серной кислотой поставим коэффициент 16, чтобы уравнять количество сульфатных групп:
Последний коэффициент перед водой поставим по кислороду, игнорируя сульфатные группы, поскольку их количество уравнено. Слева мы видим 28 атомов кислорода. Справа, не считая воды, 9 атомов кислорода. Таким образом, перед водой необходимо поставить коэффициент 19.
Далее, подсчитав водород в обеих частях уравнения, убеждаемся, что коэффициенты расставлены верно.
Видео:Окисление органических соединений перманганатом калияСкачать

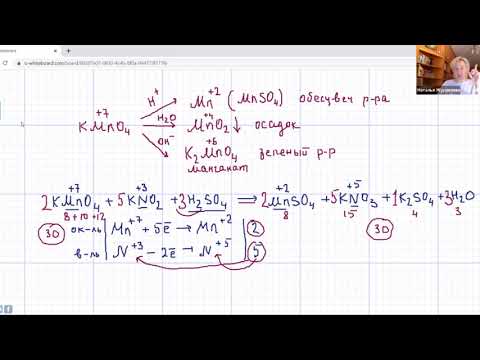
2 — метилпропен — 1 + kmno4 + h2so4 (электронный баланс)?
Химия | 10 — 11 классы
2 — метилпропен — 1 + kmno4 + h2so4 (электронный баланс).
5CH3 — C(CH3) = CH2 + 8KMnO4 + 12H2SO4 = = 5CH3 — CO — CH3 + 5CO2 + 4K2SO4 + 8MnSO4 + 17H2O
C(0) — 2e = C( + 2) | 8 5
Mn( + 7) + 5e = Mn + 2 | 5 8.
Видео:Реакция этилена с раствором перманганата калияСкачать

FeSO₄ + KMnO₄ — — [H⁺] — — — > ; / Fe³⁺ / методом электронного баланса?
FeSO₄ + KMnO₄ — — [H⁺] — — — > ; / Fe³⁺ / методом электронного баланса.
Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Составить электронный баланс?
Составить электронный баланс.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Как решать уравнения электронного баланса?
Как решать уравнения электронного баланса?
Видео:Алкины.Окисление алкинов с KMnO4 и K2Cr2O7. Все 9 реакций ЕГЭСкачать

Карбид алюминия электронный баланс?
Карбид алюминия электронный баланс.
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Электронный баланс fe + Hcl?
Электронный баланс fe + Hcl.
Видео:Взаимодействие ацетилена с раствором перманганата калияСкачать

Химия?
Помогите с электронным балансом.
Видео:Получение кислорода из перманганата калияСкачать

Электронный баланс S + H2?
Электронный баланс S + H2.
Видео:Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Срочно ?
Электронный и ионный баланс.
Видео:Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

Подвести электронный баланс?
Подвести электронный баланс.
Видео:Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Электронный баланс Mg + HCL?
Электронный баланс Mg + HCL.
Вы перешли к вопросу 2 — метилпропен — 1 + kmno4 + h2so4 (электронный баланс)?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
Эту электронную формулу имеет ион O( — 2) 2) О( — 2).
Fe2O3 + 3H2 = > 2Fe + 3H2О Условие непонятно. Чего 16 г — оксида или железа? По — видимому оксида, потому что его молярная масса равна 160 г / моль. Тогда : на 160 г оксида требуется 3 * 22, 4 = 67, 2 л водорода на 16 г — 6, 72 л водорода.
Дано : m(FeO) = 16 г Найти : V(H2) — ? M(FeO) = 72 г / моль n(FeO) = m / M = 16 г / 72 г / моль = 0, 222 моль FeO + H2 = Fe + H2O Из УХР следует что n(H2) = n(FeO) = 0, 222 моль V(H2) = n * Vm = 0, 222 моль * 22, 4 л / моль = 4, 973 л Ответ : 4, 973..
1) реакция Соединения 2) KCl = K + Cl (реакция решена неверно у вас). Реакция разложения. 3) Реакция замещения 4) Рекция обмена.
1)соединение 2)разложение 3)замещение 4)обмен.
Простое вещество : б, г, д элемент : а, в, е, ж.
NaCl n = N / NA = 30 / 6, 02 = 4, 98 m = M * n = 58, 5 * 5 = 292, 5 N = 30 * 10 ^ 23 V = Vm * n = 22, 4 * 5 = 112 M = Mr = 58, 5 CO2 n = 10 m = 440 N = n * NA = 60, 2 V = 10 * 22, 4 = 224 M = 44 CuSO4 n = 640 / 160 = 4 m = 640 N = 24, 08 V = 89. 6 M..
N = (ѡ(c) / Ar(C) * 100) * M(CnH2n) n(C) = 85, 7 / 1200 * 28 = 2 n(H) = 14, 3 / 100 * 28 = 4 Формула = С2Н4.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaClFeS + 2HCl(разб. ) = FeCl2 + H2S↑2Cu(OH)2 + H2SO4(нед. ) = (CuOH)2SO4 + 2H2O.
Радиус атома увеличивается, электроотрицательность уменьшается, металлические свойства усиливаются. ( вроде бы всё).
Видео:Окислительно-восстановительное титрование: перманганатометрия.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 Видео21 11 18 Вебинар Окислительно восстановительные реакции в органической химииСкачать  Окислительно-восстановительные реакции | Химия 10 класс | УмскулСкачать  КАК РЕШАТЬ 35 ЗАДАНИЕ НА ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО ЕГО РЕАКЦИОННОЙ СПОСОБНОСТИ. ХИМИЯ ЕГЭСкачать  Химия. 10 класс. Окислительно-восстановительные реакции с участием бинарных веществ /18.11.2020/Скачать  Окислительно-восстановительные процессы в химии, часть 2Скачать  Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать  |










