Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать  Составьте уравнение реакции гидролиза этилацетата ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ для студентов биолого-почвенного факультета Работа № 2 Задания к работе 1. Изучить кинетику реакции гидролиза этилацетата методом отбора проб при двух температурах. 2. Определить графическим и аналитическим методами среднюю константу скорости реакции при каждой температуре. 3. Рассчитать температурный коэффициент константы скорости и энергию активации реакции. Гидролиз этилацетата протекает следующим образом: СН3СООС2Н5 + Н2О В нашем случае реакция проводится в присутствии соляной кислоты, что значительно увеличивает скорость реакции. По мере протекания реакции гидролиза концентрация ионов водорода в реакционной смеси увеличивается; скорость реакции определяют, оттитровывая пробы через некоторые промежутки времени. В две пронумерованные чистые сухие колбы емкостью 100 мл наливают по 50 мл 0.2 M раствора соляной кислоты; колбы помещают в термостаты с указанной преподавателем температурой (например, колба № 1 — 25 °С, колба № 2 — 30 °С). После того, как растворы примут температуру термостата (через 10-15 минут), к ним приливают по 5 мл этилацетата и, перемешав содержимое колбы, немедленно отбирают пипеткой пробу объемом 2 мл. Момент отбора первой пробы считают началом реакции. Добавление этилацетата в колбу № 2 производят через 5-10 минут после начала реакции в колбе № 1. Взятую пробу выливают в колбу с 40 — 50 мл предварительно охлажденной дистиллированной воды (t от 0 до 2 °С) для торможения реакции и титруют 0.05 н. раствором NаОН с фенолфталеином до появления устойчивого слабо-розового окрашивания. Следующие пробы отбирают через 15, 30, 45, 60 и 75 минут после начала реакции. Титрование первой пробы позволяет определить концентрацию соляной кислоты в реакционной смеси. Для определения исходной концентрации этилацетата необходимо оттитровать пробу, взятую после окончания реакции. Для ускорения реакции гидролиза эфира одну из колб после отбора последней пробы нагревают с обратным холодильником на водяной бане при температуре 70 — 80 °С в течении 30 минут и, охладив раствор, титруют пробу объемом 2 мл. Константы скорости для каждого момента времени вычисляют по формуле (1) и затем находят среднее значение: Здесь t — время от начала реакции, мин; Аналогичные вычисления производят для каждой температуры. Полученные результаты заносят в таблицу 1. Видео:Гидролиз солей. 1 часть. 11 класс.Скачать  Щелочной гидролиз этилацетата — реакция второго порядка с константой скорости k = 0,084 л/(моль*с). Взят 1 л 0,05 М раствора этилацетата. Какое время понадобится Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы. Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня! Описание и исходные данные задания, 50% решения + фотография:Щелочной гидролиз этилацетата — реакция второго порядка с константой скорости k = 0,084 л/(моль*с). Взят 1 л 0,05 М раствора этилацетата. Какое время понадобится для образования 1,15 г этанола при исходной концентрации щелочи: а) 0,05 М; б) 0,1 М ? Решение: количество образованного этанола: n ( C 2 H 5 OH ) = m ( C 2 H 5 OH )/ M ( C 2 H 5 OH ) = 1,15/46 = 0,025 моль то есть концентрация эфира и щелочи уменьшится на 0,025 моль/л а) рассчитаем конечные концентрации щелочи и эфира: С( CH 3 COOC 2 H 5 ) = С( KOH ) = 0,05-0,025 = 0,025 моль/л
Присылайте задания в любое время дня и ночи в ➔ Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института. Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды. Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги. 🌟 ВидеоГидролиз солей. 9 класс.Скачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать  Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Всё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать  Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать  ЩЕЛОЧНОЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать 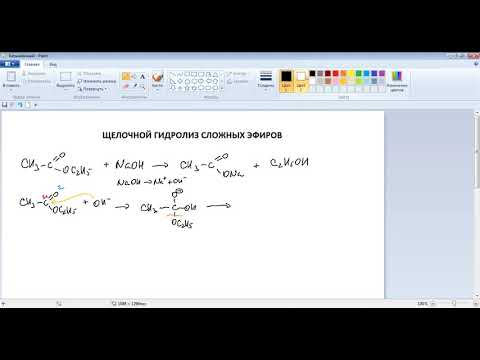 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Гидролиз солейСкачать  Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать  11 класс. Гидролиз солей.Скачать  Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать  Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать  Гидролиз солей.ПримерыСкачать  Электролиз. 10 класс.Скачать  Гидролиз солей. Практическая часть. 10 класс.Скачать  РАЗБОР ТЕМЫ ГИДРОЛИЗ | ПОДГОТОВКА К ЕГЭ ПО ХИМИИ 2023 |21 ЗАДАНИЕ ЕГЭ 2023|ЖЕНЯ ХИМИЧКА ЕГЭЛЕНДСкачать  |


 С2Н5ОН + СН3СООН
С2Н5ОН + СН3СООН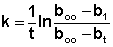 (1)
(1) Готовое решение: Заказ №8423
Готовое решение: Заказ №8423 Тип работы: Задача
Тип работы: Задача Статус: Выполнен (Зачтена преподавателем ВУЗа)
Статус: Выполнен (Зачтена преподавателем ВУЗа) Предмет: Химия
Предмет: Химия Дата выполнения: 05.09.2020
Дата выполнения: 05.09.2020 Цена: 209 руб.
Цена: 209 руб.

