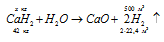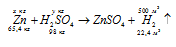Кальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель.
Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор :
2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород:
4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция:
4CaO + 2Al = 3Ca + Ca(AlO2)2
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Качественная реакция
Кальций окрашивает пламя газовой горелки в коричнево-красный цвет.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства
1. Кальций — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом . При этом образуются соответствующие соли :
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.1. Кальций при комнатной температуре реагирует с водой . Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода:
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород :
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Задания по неорганической химии
В данной разработке предложены задания по темам «Щелочные металлы», «Щелочноземельные металлы», «Алюминий». Данные задания можно использовать на консультациях при подготовке к ЕГЭ по химии.
Просмотр содержимого документа
«Задания по неорганической химии»
Составьте уравнения реакций взаимодействия металлического натрия с кислородом, водородом, азотом, серой, фосфором, газообразным хлороводородом, безводным хлоридом алюминия, водой, раствором хлорида цинка.
Напишите уравнения практически осуществимых реакций:
Пероксида натрия с углекислым газом
Пероксида натрия с натрием
Калия с хлоридом алюминия
Пероксида натрия с угарным газом
Гидрида лития с водой
Гидрида натрия с соляной кислотой
Сульфида натрия с концентрированной азотной кислотой
Напишите уравнения практически осуществимых реакций:
Сульфида калия с концентрированной и разбавленной серной кислотой
Холодного раствора гидроксида калия с хлором и бромом
Горячего раствора гидроксида натрия с хлором и бромом
Гидроксида натрия с цинком
Раствора гидроксида калия с алюминием
Раствора гидроксида натрия с кремнием
Горячего раствора карбоната калия с хлором
Нитрида натрия с водой
Напишите уравнения реакций, которые позволяют осуществить следующие превращения:
Составьте уравнения практически осуществимых реакций кальция с кислородом, водородом, хлоридом калия, водой, азотом, серой, оксидом железа (III), соляной кислотой, разбавленной и концентрированной серной кислотой, разбавленной и очень разбавленной азотной кислотой, обжига известняка.
Напишите уравнения практически осуществимых реакций:
Гидрида кальция с водой
Оксида кальция с водой
Оксида кальция с оксидом магния
Гидроксида кальция с оксидом алюминия
Оксида кальция с сернистым газом
Гидроксида кальция с углекислым газом
Кальция с твердым хлоридом железа (II)
Оксида кальция с оксидом кремния (IV)
Оксида кальция с коксом
Оксида кальция с оксидом алюминия
Ацетиленида кальция с водой
Фосфида магния с водой
Нитрида кальция с соляной кислотой
Напишите уравнения реакций, которые надо провести для осуществления следующих превращений:
Составьте уравнения реакций алюминия с кислородом, хлором, серой, фосфором, соляной кислотой, разбавленной серной кислотой, сульфатом меди (II), железной окалиной, водой, концентрированной и разбавленной азотной кислотой, концентрированной серной кислотой, раствором гидроксида калия.
Напишите уравнения практически осуществимых реакций:
Оксида алюминия с твердым гидроксидом натрия
Оксида алюминия с карбонатом калия
Оксида алюминия с раствором гидроксида натрия
Нагревания гидроксида алюминия
Гидроксида алюминия с раствором едкого кали
Сплавления гидроксида алюминия с едким натром
Растворения метаалюмината натрия в воде и соляной кислоте
Хлорида алюминия с гидроксидом натрия
Тетрагидроксоалюмината калия с азотной кислотой
Сульфида алюминия с водой
Раствора тетрагидроксоалюмината натрия с углекислым газом
Электролиза оксида алюминия
Каким образом можно определить, что в состав вещества входят ионы алюминия?
Напишите уравнения реакций, которые надо провести для осуществления следующих превращений:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидриды металлов, получение и свойства
Задача 794.
Как получают гидриды металлов? Составить уравнения реакций: а) получения гидрида кальция; б) взаимодействия его с водой.
Решение:
Соединения водорода с металлами называют гидридами. Гидриды металлов получают при нагревании металла в струе водорода. Гидриды имеют ионное строение, так металл кальций входит в состав СаН2 в виде иона Са 2+ , а водород – в виде аниона Н — . Таким образом, можно сделать вывод, что гидриды – солеподобные соединения.
а) При нагревании в струе водорода металлический кальций соединяется с водородом, образуя гидрид кальция:
б) Гидрид кальция СаН2 – солеподобное вещество белого цвета, которое гидролизуется как соль сильного основания и слабой кислоты по аниону:
Эта реакция может служить удобным методом для получения водорода в лабораторных условиях. Гидрид кальция можно использовать в качестве эффетивного осушителя воздушных, газовых и жидких неводных смесей, а также для количественного определения содержания воды в органических соединениях и кристаллогидратах и т.д. СаН2 служит для обнаружения следов воды.
Задача 795.
Для наполнения аэростатов в полевых условиях иногда пользуются взаимодействием гидрида кальция с водой. Сколько килограммов СаН2 придется израсходовать для наполнения аэростата объемом 500 м 3 (считая условия нормальными)? Сколько потребуется для этой цели цинка и серной кислоты?
Решение:
а) Уравнение реакции имеет вид:
Молекулярная масса СаН2 равна 42 а. е. м., значит, СаН2 – 42кг/кмоль. Массу СаН2 находим из пропорции:
х : 500 = 42 : 44,8; х = (42 . 500)/44,8 = 468,75кг.
б) Уравнение реакции имеет вид:
Массу цинка находим из пропорции:
х : 500 = 65,4 : 22,4; х = (65,4 . 500)/22,4 = 1459,82кг.
Массу серной кислоты находим из пропорции:
у : 500 = 98 : 22,4; х = (98 . 500)/22,4 = 2187,50кг.
Ответ: m(CaH2) = 468,75кг, m(Zn) = 1459,82кг, m(H2SO4) = 2187,50кг.
Задача 796.
Почему водород и кислород не взаимодействуют при обычной температуре, а при 700 °С реакция протекает практически мгновенно?
Решение:
Атомы водорода в молекуле Н2 и атомы кислорода в молекуле О2 соединены между собой очень прочными ковалентными связями. Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции. Поэтому любое столкновение между молекулами Н2 и О2 при обычной температуре и атмосферном давлении оказывается неэффективным. И только при повышении температуры, когда кинетическая энергия сталкивающихся молекул Н2 и О2 делается большой, некоторые соударения молекул Н2 и О2 становятся эффективными и приводят к образованию активных центров, что даёт начало реакции взаимодействия водорода с кислородом, т. е. реакция инициируется, и скорость её резко возрастает. При смешивании водорода и кислорода в отношении 2 : 1 можно получить взрыв, если инициировать реакции, например ударом. При 300 °С в смеси Н2 и О2 через несколько дней образуется немного Н2О, а при 500 0 С водород полностью соединяется с кислородом за несколько часов, при нагревании смеси до 700 0 С происходит быстрый подъём температуры и реакция заканчивается со взрывом. Поэтому чтобы взорвать смесь Н2 и О2 нужно подогреть её до 700 °С хотя бы в одном месте.
📸 Видео
Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия | Молекулярные и ионные уравненияСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Решение цепочек превращений по химииСкачать

Химические уравнения. Как составлять химические уравнения.Скачать

Гидролиз солей. 9 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать