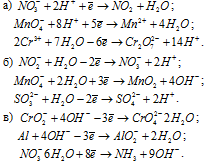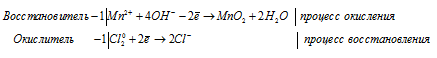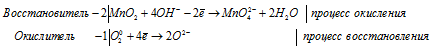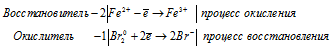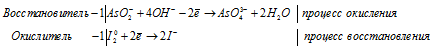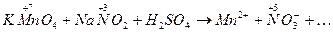Любая окислительно-восстановительная реакция состоит из двух «половинок» — в ходе ОВР идут два процесса — процесс окисления вещества-восстановителя и процесс восстановления вещества-окислителя. Оба эти процесса могут быть описаны соответственными ионными уравнениями, которые потом можно суммировать и получить итоговое общее ионное уравнение реакции, а потом записать молекулярное уравнение.
В качестве примера составим уравнение реакции сероводорода с раствором калия перманганата в кислой среде методом полуреакций. Ранее это уравнение было составлено методом электронного баланса.
В ходе реакции происходит разложение молекул сероводорода на серу и водород, о чем свидетельствует постепенное помутнение раствора перманганата калия (сера выпадает в осадок). Процесс окисления сероводорода запишем в виде уравнения полуреакции окисления:
Поскольку в левой и правой частях схемы кол-во атомов серы и водорода равно, то стрелку можно заменить на знак равенства, уравняв предварительно число зарядов в исходном веществе и продуктах реакции:
Параллельно с помутнение раствора идет и смена его окраски — из малинового раствор становится бесцветным,что объясняется переходом ионов MnO4 — , имеющих малиновую окраску, в практически бесцветный катион марганца Mn 2+ . Эта полуреакция восстановления выражается схемой:
А куда же делся атом кислорода? — обязательно спросит внимательный читатель. В кислой среде атом кислорода, входящий в состав иона, соединяется с атомами водорода, выделяющимися в ходе полуреакции окисления, образуя молекулу воды, при этом, поскольку из одного иона освобождается аж 4 атома кислорода, то для их связывания требуется 8 атомов водорода:
Чтобы уравнять заряды в левой и правой части схемы, в левую часть надо добавить 5 электронов (в левой части сумма зарядов +7, а в левой +2):
Для получения суммарного уравнения реакции, необходимо почленно сложить две полуреакции, предварительно уравняв кол-во отданных и полученных электронов, по аналогии с методом электронного баланса:
Проверяем кол-во атомов и заряды в левой и правой частях суммарного уравнения, они равны, значит уравнение составлено правильно (водорода — по 16 атомов; серы — по 5; марганца — по 2; кислорода — по 8; заряды — по +4).
Чтобы перейти от ионного уравнения к молекулярному, надо в левой части подобрать к катионам и анионам их «пары» — анионы и катионы соответственно, после чего подобранные ионы записать и в правую часть уравнения, после этого ионы объединяются в молекулы, и получается молекулярное уравнение.
Результат аналогичен уравнению, полученному методом электронного баланса.
- Правила составления уравнений ОВР методом полуреакций
- Пример составления уравнения ОВР для кислотной среды
- Пример составления уравнения ОВР для кислотной среды
- Пример составления уравнения ОВР для нейтральной среды
- Составление уравнений полуреакций окисления с учетом кислотности среды
- Метод электронно-ионных полуреакций
- 🔍 Видео
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Правила составления уравнений ОВР методом полуреакций
- На первом этапе в ионном виде записывают полуреакцию окисления и полуреакцию восстановления, в которых указывают вещество-восстановитель и вещество-окислитель, с продуктами их реакции.
- Сильные электролиты записываются в виде ионов.
- Слабые электролиты, газы и твердые вещества, выпадающие в осадок — в виде молекул.
- Продукты реакции между восстановителем и окислителем устанавливаются по справочникам или по «шпаргалке», приведенной на странице «Определение продуктов ОВР» (это самый сложный этап для начинающих).
- Записывают схему реакции, в которой многоточием обозначают неизвестные продукты реакции.
- Что делать с кислородом:
- Если в исходном веществе кислорода содержится больше, чем в продуктах реакции, то «лишний» кислород в растворах с кислой средой связывается с катионами водорода, образуя молекулы воды (O -2 +2H + =H2O); в нейтральных растворах — в гидроксид-ионы: O -2 +H2O=2OH — ;
- Если в исходном веществе кислорода содержится меньше, чем в продуктах реакции, то «недостающий» кислород «забирается» из молекул воды (в растворах с кислой и нейтральной средой): H2O=O -2 +2H + ; в щелочных растворах — за счет гидроксид-ионов: 2OH — =O -2 +H2O.
- В левой и правой частях уравнения должны быть равны суммарное число и знак электрических зарядов.
Достоинства метода полуреакций:
- Работают с реально существующими ионами (MnO4 — ), а не виртуальными (Mn +7 ).
- Нет необходимости знать степени окисления атомов.
- Прослеживается роль среды, в которой происходит взаимодействие веществ.
- Не нужно знать все продукты реакции, они выводятся «сами собой» в процессе составления уравнения.
Пример составления уравнения ОВР для кислотной среды
Составление уравнения реакции серы с азотной кислотой:
- S+HNO3
- S 0 → SO4 2- — процесс окисления восстановителя.
- NO3 — → NO — процесс восстановления окислителя.
- Приводим в «порядок» первую полуреакцию окисления:
- S 0 → SO4 2- — отличник должен здесь спросить, откуда справа взялся кислород? Немного терпения, сейчас все станет ясно.
- в правую часть схемы, где присутствует избыток кислорода, добавляется катион водорода:
S 0 → SO4 2- +H + - у внимательного читателя тут же должен возникнуть вопрос — а откуда взялся катион водорода? Отвечаем: из молекулы воды, которая добавляется в левую часть схемы:
S 0 +H2O → SO4 2- +H + - Вот теперь настало время уравнять в обеих частях схемы кислород, который, теперь понятно, откуда взялся:
S 0 +4H2O → SO4 2- +H + - Теперь надо уравнять водород:
S 0 +4H2O → SO4 2- +8H + - С атомами элементов в обеих частях схемы полный порядок, осталось разобраться с зарядами — в левой части заряд нулевой; в правой: (-2)+8(+1)=+6:
S 0 +4H2O-6e — → SO4 2- +8H +
- Делаем аналогичную работу со второй полуреакцией восстановления:
- NO3 — → NO
- Добавляем водород, в левую часть, где присутствует «лишний» кислород:
NO3 — +H + → NO - В правую часть добавляем воду:
NO3 — +H + → NO+H2O - Уравниваем кислород:
NO3 — +H + → NO+2H2O - Уравниваем водород:
NO3 — +4H + → NO+2H2O - Уравниваем заряды:
NO3 — +4H + +3e — → NO+2H2O
- Уравниваем кол-во электронов, которые были отданы и приняты в двух полуреакциях:
- Суммируем левые и правые части, предварительно умножив на коэффициент (2) члены второй полуреакции:
- Проводим сокращение одинаковых членов в левой и правой частях схемы и добавляем в пару к анионам «нужные» катионы, чтобы образовались молекулы, в нашем случае это будут молекулы азотной и серной кислоты, для этого мы добавим катион водорода (2H + ):
- Суммарное молекулярное уравнение:
S+2HNO3 = H2SO4+2NO — в результате взаимодействия серы с азотной кислотой получается серная кислота и оксид азота (II).
Пример составления уравнения ОВР для кислотной среды
«Фокус» уравнивания кол-ва атомов кислорода и водорода для уравнений ОВР в щелочной среде заключается в следующем:
- Вода (H2O) добавляется в ту часть полуреакции, в которой присутствует избыток кислорода.
- Соответственно, в противоположную часть уравнения-схемы добавляется удвоенное число гидроксид-ионов (OH — ).
- Перед формулой молекулы воды ставится коэффициент, уравнивающий разницу кол-ва атомов кислорода в левой и правой частях полуреакции.
- Перед формулой гидроксид-иона ставится удвоенный коэффициент.
- Восстановитель присоединяет атомы кислорода из гидроксид-ионов.
- MnO2+KClO3+KOH → ?
- MnO2 → MnO4 2- оксид марганца является восстановителем, он будет связывать гидроксид-ионы.
- Поскольку в правой части схемы килорода больше (на 2 атома), то вода добавляется сюда же, перед ее формулой ставится коэффициент 2, соответственно, в левую часть схемы полуреакции добавляют 4 гидроксид-иона:
MnO2+4OH — → MnO4 2- +2H2O - Уравниваем заряды:
MnO2+4OH — -2e — → MnO4 2- +2H2O - ClO3 — → Cl — — полуреакция восстановления.
- Избыток кислорода (3 «лишних» атома) находится в левой части схемы полуреакции, сюда же добавляем и 3 молекулы воды, а в правую часть 6 гидроксид-ионов:
ClO3 — +3H2O → Cl — +6OH — - Уравниваем заряды:
ClO3 — +3H2O+6e — → Cl — +6OH — - Уравниваем в полуреакциях кол-во отданных и принятых электронов (6 и 2 сокращаем на 2), и получаем суммарное уравнение, путем сложения двух уравнений полуреакций:
- Проводим сокращение подобных слагаемых и добавляем катионы калия, чтобы перейти к молекулярной форме уравнения реакции:
- Молекулярное уравнение реакции:
3MnO2+6KOH+KClO3 = 3K2MnO4+3H2O+KCl
Пример составления уравнения ОВР для нейтральной среды
Среду нейтральной можно счситать лишь условно, в любом случае, среда будет либо слабощелочной, либо слабокислотной.
Составляя уравнение ОВР методом полуреакций для нейтральной среды, одну полуреакцию составляют, как для кислотной среды — в левую часть схемы добавляют молекулу воды, в правую — катион водорода), вторую — как для щелочной (в левую часть добавляют молекулу воды, в правую — гидроксид-ион).
- Na2SO3+KMnO4+H2O
- SO3 2- → SO4 2- — процесс окисления восстановителя;
- MnO4 — → MnO2 — процесс восстановления окислителя;
- Схема реакции:
SO3 2- +MnO4 — → SO4 2- +MnO2+. - Составляем уравнения полуреакций:
- Молекулярное уравнение:
Еще один пример:
- S+KMnO4 → ?
- S → SO4 2-
- MnO4 — → MnO2
- Первую полуреакцию оформляем, как для кислотной среды; вторую — как для щелочной:
- Сокращаем обе части равенства на 8 молекул воды, и добавляем катионы калия:
- Молекулярное уравнение:
S+2KMnO4 = K2SO4+2MnO2
Более подробно составление уравнений окислительно-восстановительных реакций методом полуреакций в различных средах рассмотрено на странице Влияние среды на протекание ОВР.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Составление уравнений полуреакций окисления с учетом кислотности среды
Задача 625.
Составить уравнения полуреакций окисления с учетом кислотности среды: 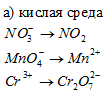
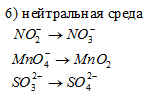
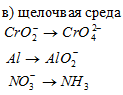
Решение:
Задача 626.
Закончить уравнения реакций:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
б) MnO2 + O2 + KOH = K2MnO4 +
в) FeSO4 + Br2 + H2SO4 =
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
Решение:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
Одна молекула Mn(OH)2 превращается в один ион Mn 2+ и два иона OH — :
Источником кислорода для протекания процесса превращения Mn 2+ в MnO2 служат ионы OH — в щелочной среде. Окислителем данного процесса являются атомы хлора из молекул Cl2.
Марганец повышает свою степень окисления от +4 до +6, т. е. проявляет свойства восстановителя, а кислород понижает свою степень окисления от 0 до -2, проявляя свойства окислителя.
Молекулярная форма процесса:
2Fe 2+ + Br2 0 = 2Fe 3+ + 2Br —
Молекулярная форма процесса:
г) NaAsO 2 + I 2 + NaOH = Na 3 AsO 4 +
AsO 2- + I2 0 + 4OH — = AsO4 3- + 2I — + 2H2O
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Метод электронно-ионных полуреакций
Составление уравнений ОВР данным методом рекомендуется выполнять в следующей последовательности:
· рассчитать степени окисления атомов элементов и по изменению степеней окисления определить окислитель и восстановитель;
· составить ионную схему реакции, выделить окислительно-восстановительные пары;
· составить электронно-ионные уравнения полуреакций окисления и восстановления, в которых уравнять число атомов элементов и заряд обеих частей полуреакций в определённой очерёдности:
· число атомов элементов, отличающихся от кислорода и водорода,
· число атомов кислорода,
· число атомов водорода,
· заряд обеих частей полуреакций;
· суммировать уравнения полуреакций с учётом дополнительных множителей, подобранных таким образом, чтобы уравнять число принятых и отданных электронов;
· в полученном ионном уравнении при необходимости выполнить алгебраические преобразования, и на его основе составить молекулярное уравнение.
Последовательность составления уравнений рассмотрим на конкретных примерах ОВР с заданными продуктами.
Пример 1.Реакция в кислой среде между перманганатом калия и нитритом натрия. Схема реакции:
· Составляем ионную схему реакции, записав, как в ионных уравнениях, сильные растворимые электролиты в виде ионов, а остальные вещества виде молекул:
Рассчитываем степени окисления элементов, определяем окислитель и его восстановленную форму, восстановитель и его окисленную форму – окислительно-восстановитель-ные пары:
· Составляем уравнения полуреакций. Уравниваем в левой и правой частях каждой полуреакции число атомов всех элементов. Число атомов марганца и азота одинаково в обеих частях полуреакций. Уравнивание числа атомов кислорода и водорода выполняют с учётом среды, в которой происходит реакция. Если ОВР проходит в кислой среде, для уравнивания числа атомов кислорода и водорода в уравнения полуреакций можно включать только молекулы воды и ионы водорода:
Таким образом, чтобы уравнять число атомов кислорода, а затем атомов водорода в кислой среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать n молекул воды, а в противоположную часть 2n ионов водорода.
· Уравниваем сумму зарядов ионов в левой и правой частях полуреакций, записывая в левую часть необходимое число электронов со знаками (+) или (–).
В первой полуреакции алгебраическая сумма зарядов ионов в левой части равна -1 + 8(+1) = +7, в правой равна +2, для уравнивания зарядов необходимо к левой части прибавить 5 электронов.
MnO4 — + 8H + + 5 
В левой части второй полуреакции надо вычесть 2 элек-трона:
NO2 — + H2O — 2 
· Уравниваем число отданных и принятых электронов наименьшими множителями – коэффициентами и суммируем уравнения, умножив каждое слагаемое на соответствующий коэффициент:


NO2 — + H2O — 2 
 |
· Приводим подобные члены в суммарном уравнении
и по полученному краткому ионному уравнению дописы-ваем молекулярное уравнение:
· (Пояснить появление K2SO4 в продуктах реакции) Уравнение считается законченным, когда в продуктах реакции и исходных веществах содержится одинаковое число атомов каждого элемента.
Пример 2. Реакция между сульфатом марганца (II) и гипохлоритом калия в щелочной среде:
Уравнение составляем в той же последовательности, которая приведена для реакций в кислой среде.
· Ионная схема реакции:
Mn 2+ + SO4 2– + K + + ClO – + Na + + OH – ® MnO2 + Cl – +.
В исходных реагентах дана щелочь – NaOH, поэтому уравнения полуреакций составляем с учетом щелочной среды: число атомов кислорода и водорода уравниваем гидроксид-ионами ОН — и молекулами воды:
ClO – + H2O ® Cl – + 2OH – .
Чтобы уравнять число атомов кислорода, а затем атомов водорода в щелочной среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать 2n гидроксид-ионов ОН-, а в противоположную часть n молекул воды.
· Уравниваем заряды левой и правой частей уравнений полуреакций:
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
т.е. первая полуреакция — окисление восстановителя, вторая восстановление окислителя.
· Суммируем уравнения полуреакций:
 |
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
 |
Mn 2+ + ClO – + 4OH – + H2O = MnO2 + Cl – + 2H2O + 2OH –
· Приводим подобные члены:
Mn 2+ + ClO – + 2OH – = MnO2 + Cl – + H2O.
Пример 3.Реакция между перманганатом калия и нитритом натрия в нейтральной среде:
Будем придерживаться рекомендованной ранее последо-вательности операций.
· В ионную схему можно не включать молекулы и ионы, не участвующие в полуреакциях:
· При составлении уравнений реакций, протекающих в нейтральной среде, необходимо иметь в виду, что в левой части уравнений полуреакций не должно быть ионов Н + и ОН — , а в правой части эти ионы можно использовать.
Соответствующие уравнения полуреакций:
MnO4 — + 2H2O + 3 
NO2 — + H2O – 2 
Таким образом, в нейтральной среде число атомов кислорода и водорода уравнивают по-разному, в зави-симости от того, в какую часть полуреакции необходимо ввести недостающие атомы. Если в правой части уравнения полуреакции недостаёт n атомов кислорода, в неё следует добавить 2n гидроксид-ионов, а в левую часть – n молекул воды. Если в левой части уравненияполуреакции недостаёт n атомов кислорода, в неё следует добавить n молекул воды, а в правую часть – 2n ионов водорода.
· Суммируем уравнения полуреакций:


NO2 — + H2O – 2 
 |
 |  |
· После объединения ионов OH — и H + в молекулы воды приводим подобные члены и получаем ионное уравнение реакции:
Представим схематически уравнивание числа атомов кислорода и водорода в различных средах, (обозначаем 
кислая среда — 
Н2О = 
щелочная среда — 
2ОН — = 
нейтральная среда 
Н2О = 
Очевидно, что для уравнивания числа атомов кислорода существует всего два отличающихся приёма: добавление в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, 2n гидроксид-ионов (если это позволяет данная среда), или n молекул воды.
Дата добавления: 2015-08-08 ; просмотров: 5896 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
🔍 Видео
Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 3ч. 10 класс.Скачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 5ч. 10 класс.Скачать

Решение ОВР методом полуреакцийСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. 9 класс.Скачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

ВСЯ ХИМИЯ 10 КЛАСС ОВР / Метод полуреакций / Ионно-электронный баланс WannaBeTeacher Усенов УланСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

СОСТАВНЫЕ УРАВНЕНИЯ / Математика 3 ,4 класс Петерсон , Моро . Как научить решать составные уравненияСкачать

Стрим по ОВР. Органика и Неорганика. Вся теория для ЕГЭ + метод полуреакцийСкачать

4 класс: как легко составить уравнение по задаче?Скачать

ОВР - метод полуреакцийСкачать

Все ОВР с кислотами и простыми веществами | Кислая горелочка. Интенсив | Катя СтрогановаСкачать

Реакция окисления-восстановления. Метод полуреакций | Задача из задачника ГлинкаСкачать

ВСЯ ХИМИЯ 9 КЛАСС Электролитическая диссоциация / Гидролиз солей WannaBeTeacher Усенов УланСкачать