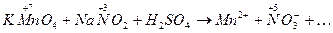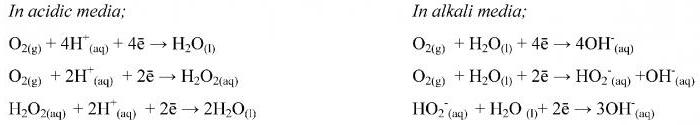Составление уравнений ОВР данным методом рекомендуется выполнять в следующей последовательности:
· рассчитать степени окисления атомов элементов и по изменению степеней окисления определить окислитель и восстановитель;
· составить ионную схему реакции, выделить окислительно-восстановительные пары;
· составить электронно-ионные уравнения полуреакций окисления и восстановления, в которых уравнять число атомов элементов и заряд обеих частей полуреакций в определённой очерёдности:
· число атомов элементов, отличающихся от кислорода и водорода,
· число атомов кислорода,
· число атомов водорода,
· заряд обеих частей полуреакций;
· суммировать уравнения полуреакций с учётом дополнительных множителей, подобранных таким образом, чтобы уравнять число принятых и отданных электронов;
· в полученном ионном уравнении при необходимости выполнить алгебраические преобразования, и на его основе составить молекулярное уравнение.
Последовательность составления уравнений рассмотрим на конкретных примерах ОВР с заданными продуктами.
Пример 1.Реакция в кислой среде между перманганатом калия и нитритом натрия. Схема реакции:
· Составляем ионную схему реакции, записав, как в ионных уравнениях, сильные растворимые электролиты в виде ионов, а остальные вещества виде молекул:
Рассчитываем степени окисления элементов, определяем окислитель и его восстановленную форму, восстановитель и его окисленную форму – окислительно-восстановитель-ные пары:
· Составляем уравнения полуреакций. Уравниваем в левой и правой частях каждой полуреакции число атомов всех элементов. Число атомов марганца и азота одинаково в обеих частях полуреакций. Уравнивание числа атомов кислорода и водорода выполняют с учётом среды, в которой происходит реакция. Если ОВР проходит в кислой среде, для уравнивания числа атомов кислорода и водорода в уравнения полуреакций можно включать только молекулы воды и ионы водорода:
Таким образом, чтобы уравнять число атомов кислорода, а затем атомов водорода в кислой среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать n молекул воды, а в противоположную часть 2n ионов водорода.
· Уравниваем сумму зарядов ионов в левой и правой частях полуреакций, записывая в левую часть необходимое число электронов со знаками (+) или (–).
В первой полуреакции алгебраическая сумма зарядов ионов в левой части равна -1 + 8(+1) = +7, в правой равна +2, для уравнивания зарядов необходимо к левой части прибавить 5 электронов.
MnO4 — + 8H + + 5 
В левой части второй полуреакции надо вычесть 2 элек-трона:
NO2 — + H2O — 2 
· Уравниваем число отданных и принятых электронов наименьшими множителями – коэффициентами и суммируем уравнения, умножив каждое слагаемое на соответствующий коэффициент:


NO2 — + H2O — 2 
 |
· Приводим подобные члены в суммарном уравнении
и по полученному краткому ионному уравнению дописы-ваем молекулярное уравнение:
· (Пояснить появление K2SO4 в продуктах реакции) Уравнение считается законченным, когда в продуктах реакции и исходных веществах содержится одинаковое число атомов каждого элемента.
Пример 2. Реакция между сульфатом марганца (II) и гипохлоритом калия в щелочной среде:
Уравнение составляем в той же последовательности, которая приведена для реакций в кислой среде.
· Ионная схема реакции:
Mn 2+ + SO4 2– + K + + ClO – + Na + + OH – ® MnO2 + Cl – +.
В исходных реагентах дана щелочь – NaOH, поэтому уравнения полуреакций составляем с учетом щелочной среды: число атомов кислорода и водорода уравниваем гидроксид-ионами ОН — и молекулами воды:
ClO – + H2O ® Cl – + 2OH – .
Чтобы уравнять число атомов кислорода, а затем атомов водорода в щелочной среде, необходимо в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, вписать 2n гидроксид-ионов ОН-, а в противоположную часть n молекул воды.
· Уравниваем заряды левой и правой частей уравнений полуреакций:
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
т.е. первая полуреакция — окисление восстановителя, вторая восстановление окислителя.
· Суммируем уравнения полуреакций:
 |
Mn 2+ + 4OH – –2 
ClO – + H2O + 2 
 |
Mn 2+ + ClO – + 4OH – + H2O = MnO2 + Cl – + 2H2O + 2OH –
· Приводим подобные члены:
Mn 2+ + ClO – + 2OH – = MnO2 + Cl – + H2O.
Пример 3.Реакция между перманганатом калия и нитритом натрия в нейтральной среде:
Будем придерживаться рекомендованной ранее последо-вательности операций.
· В ионную схему можно не включать молекулы и ионы, не участвующие в полуреакциях:
· При составлении уравнений реакций, протекающих в нейтральной среде, необходимо иметь в виду, что в левой части уравнений полуреакций не должно быть ионов Н + и ОН — , а в правой части эти ионы можно использовать.
Соответствующие уравнения полуреакций:
MnO4 — + 2H2O + 3 
NO2 — + H2O – 2 
Таким образом, в нейтральной среде число атомов кислорода и водорода уравнивают по-разному, в зави-симости от того, в какую часть полуреакции необходимо ввести недостающие атомы. Если в правой части уравнения полуреакции недостаёт n атомов кислорода, в неё следует добавить 2n гидроксид-ионов, а в левую часть – n молекул воды. Если в левой части уравненияполуреакции недостаёт n атомов кислорода, в неё следует добавить n молекул воды, а в правую часть – 2n ионов водорода.
· Суммируем уравнения полуреакций:


NO2 — + H2O – 2 
 |
 |  |
· После объединения ионов OH — и H + в молекулы воды приводим подобные члены и получаем ионное уравнение реакции:
Представим схематически уравнивание числа атомов кислорода и водорода в различных средах, (обозначаем 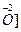
кислая среда — 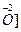
Н2О = 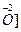
щелочная среда — 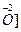
2ОН — = 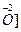
нейтральная среда 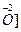
Н2О = 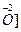
Очевидно, что для уравнивания числа атомов кислорода существует всего два отличающихся приёма: добавление в ту часть уравнения полуреакции, где недостаёт n атомов кислорода, 2n гидроксид-ионов (если это позволяет данная среда), или n молекул воды.
Дата добавления: 2015-08-08 ; просмотров: 5747 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- Метод полуреакций: алгоритм
- Метод полуреакций, сущность
- Для чего используют?
- Этапы выполнения
- Определение окислителей
- Определение восстановителей
- Преимущества электронно-ионного способа
- Полуреакции в кислом растворе
- Примеры для кислой среды
- Полуреакции для щелочной среды
- Примеры для щелочной среды
- Реакции в нейтральной среде
- Пример с нейтральной средой
- Галогены: решение задач методом полуреакций
- Уравнения ОВР соединений хлора
- Соляная кислота
- Хлорные кислоты вида HClOn
- Хлориды
- Другие соединения хлора
- 💥 Видео
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Метод полуреакций: алгоритм
Многие химические процессы проходят с изменением окислительных степеней атомов, которые образуют реагирующие соединения. Написание уравнений реакций окислительно-восстановительного типа часто сопровождается трудностью при расстановке коэффициентов перед каждой формулой веществ. Для этих целей разработаны методики, связанные с электронным или электронно-ионным балансом распределения зарядов. В статье подробно описан второй способ составления уравнений.
Видео:Решение ОВР методом полуреакцийСкачать

Метод полуреакций, сущность
Он еще называется электронно-ионным балансом распределения коэффициентных множителей. Основан метод на обмене отрицательно заряженными частицами между анионами или катионами в растворенных средах с разным значением водородного показателя.
В реакциях электролитов окислительного и восстановительного типа участвуют ионы с отрицательным или положительным зарядом. Уравнения молекулярно-ионного вида, в основе которых задействован метод полуреакций, наглядно доказывают суть любого процесса.
Для формирования баланса используют специальное обозначение электролитов сильного звена в качестве ионных частиц, а слабых соединений, газов и осадков в виде недиссоциированных молекул. В составе схемы необходимо указывать частицы, в которых изменяются степени их окисления. Для определения растворяющей среды в балансе обозначают кислые (H + ), щелочные (OH — ) и нейтральные (H2O) условия.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 3ч. 10 класс.Скачать

Для чего используют?
В ОВР метод полуреакций направлен на написание уравнений ионных отдельно для процессов окислительных и восстановительных. Конечным балансом будет их суммирование.
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Этапы выполнения
Своими особенностями написания обладает метод полуреакций. Алгоритм включает следующие стадии:
— Первым делом следует записать формулы всех реагирующих веществ. Например:
— Затем необходимо установить функцию, с химической точки зрения, каждого составляющего процесса. В данной реакции KMnO4 выступает в роли окислителя, H2S является восстановителем, а HCl определяет кислотную среду.
— Третьим этапом нужно записать с новой строки формулы ионные реагирующих соединений с сильным электролитным потенциалом, у атомов которых наблюдается смена степеней их окисления. В данном взаимодействии MnO4 — выступает в роли окисляющего вещества, H2S является восстанавливающим реагентом, а H + или оксониевый катион H3O + определяет кислотную среду. Газообразные, твердые или слабые электролитические соединения выражают целыми формулами молекулярными.
Зная исходные компоненты, постараться определить, какая у окисляющего и восстанавливающего реагента будет восстановленная и окисленная форма соответственно. Иногда конечные вещества уже заданы в условиях, что облегчает работу. В последующих уравнениях указывают переход H2S (сероводорода) в S (серу), а аниона MnO4 — в катион Mn 2+ .
Для баланса атомарных частиц в левом и правом участке в кислотную среду прибавляют водородный катион H + или молекулярную воду. В раствор щелочной вносят ионы гидроксида OH — или H2O.
В растворе атом кислорода из манганатных ионов совместно с H + формируют молекулы воды. Для выравнивания количества элементов уравнение записывают так: 8H + + MnO4 — → 4H2O + Mn 2+ .
Затем проводят электрическую балансировку. Для этого считают общую сумму зарядов в левом участке, получается +7, а затем в правой стороне, выходит +2. Для уравновешивания процесса к исходным веществам добавляется пять отрицательных частиц: 8H + + MnO4 — + 5e — → 4H2O + Mn 2+ . Получается полуреакция восстановления.
Теперь уравнять по числу атомов следует процесс окисления. Для этого в правую часть добавляют водородные катионы: H2S → 2H + + S.
После проводят уравнивание зарядов: H2S -2e — → 2H + + S. Видно, что от исходных соединений отнимают две отрицательные частицы. Получается полуреакция окислительного процесса.
Записывают оба уравнения в столбик и выравнивают отданные и принятые заряды. По правилу определения наименьших кратных подбирают для каждой полуреакции свой множитель. На него умножается окислительное и восстановительное уравнение.
Теперь можно осуществить суммирование двух балансов, сложив левые и правые стороны между собой и сократив количество электронных частиц.
8H + + MnO4 — + 5e — → 4H2O + Mn 2+ |2
H2S -2e — → 2H + + S |5
16H + + 2MnO4 — + 5H2S → 8H2O + 2Mn 2+ + 10H + + 5S
В полученном уравнении можно число H + сократить на 10: 6H + + 2MnO4 — + 5H2S → 8H2O + 2Mn 2+ + 5S.
Проверяем правильность составления ионного баланса с помощью подсчета числа кислородных атомов до стрелки и после нее, которое равняется 8. Также необходимо сверить заряды конечной и исходной части баланса: (+6) + (-2) = +4. Если все совпадает, то он составлен правильно.
Метод полуреакций заканчивается переходом от ионной записи к уравнению молекулярному. Для каждой анионной и катионной частицы левой части баланса подбирается противоположный по заряду ион. Затем их переносят в правую сторону, в таком же количестве. Теперь ионы можно соединить в целые молекулы.
6Cl — + 2K + → 6Cl — + 2K +
Применять метод полуреакций, алгоритм которого сводится к написанию молекулярного уравнения, можно наряду с написанием балансов электронного типа.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 6ч. 10 класс.Скачать

Определение окислителей
Такая роль принадлежит ионным, атомарным или молекулярным частицам, которые принимают отрицательно заряженные электроны. Вещества окисляющие претерпевают восстановление в реакциях. Они обладают электронным недостатком, который легко можно восполнить. Такие процессы включают окислительно-восстановительные полуреакции.
Не у всех веществ имеется способность присоединять электроны. К сильным окисляющим реагентам относят:
- галогеновых представителей;
- кислоту типа азотной, селеновой и серной;
- калий перманганатный, дихроматный, манганатный, хроматный;
- марганцовые и свинцовые четырехвалентные оксиды;
- серебро и золото ионное;
- соединения газообразные кислорода;
- меди двухвалентной и серебра одновалентного оксиды;
- хлорсодержащие солевые компоненты;
- водку царскую;
- водорода перекись.
Видео:Метод электронно-ионного баланса (полуреакций). Органическая химия.Скачать

Определение восстановителей
Такая роль принадлежит ионным, атомарным или молекулярным частицам, которые отдают отрицательный заряд. В реакциях восстанавливающие вещества претерпевают окислительное действие при отщеплении электронов.
- представители многих металлов;
- серы четырехвалентной соединения и сероводород;
- галогенсодержащие кислоты;
- железа, хрома и марганца сульфаты;
- олова двухвалентный хлорид;
- азотсодержащие реагенты типа кислоты азотистой, двухвалентного оксида, аммиака и гидразина;
- природный углерод и его оксид двухвалентный;
- водородные молекулы;
- кислота фосфористая.
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Преимущества электронно-ионного способа
Чтобы написать окислительно-восстановительные реакции, метод полуреакций применяют чаще, чем баланс электронного вида.
Связано это с преимуществами электронно-ионного способа :
- Во время написания уравнения рассматривают реальные ионы и соединения, которые существуют в составе раствора.
- Можно изначально не иметь информации о получающихся веществах, их определяют на конечных этапах.
- Не всегда нужны данные об окислительной степени.
- Благодаря методу можно узнать число электронов, которые участвуют в полуреакциях, как меняется водородный показатель раствора.
- По сокращенным уравнениям ионного вида изучается особенность протекания процессов и структура получившихся веществ.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 5ч. 10 класс.Скачать

Полуреакции в кислом растворе
Проведение вычислений при избытке водородных ионов подчиняется основному алгоритму. Метод полуреакций в кислой среде начинают с записи составных частей любого процесса. Потом их выражают в форме уравнений ионного вида с соблюдением баланса атомарного и электронного заряда. Отдельно записывают процессы окислительного и восстановительного характера.
Для выравнивания атомарного кислорода в сторону реакций с его избытком привносят водородные катионы. Количества H + должно хватить для получения молекулярной воды. В сторону недостатка кислорода приписывают H2O.
Затем проводят баланс водородных атомов и электронов.
Делают суммирование частей уравнений до и после стрелки с расстановкой коэффициентов.
Осуществляют сокращение одинаковых ионов и молекул. К уже записанным реагентам в суммарном уравнении выполняют добавление недостающих анионных и катионных частиц. Их количество после и до стрелочки должно совпадать.
Уравнение ОВР (метод полуреакций) считается выполненным при написании готового выражения молекулярного вида. Возле каждого компонента должен стоять определенный множитель.
Видео:метод полуреакций для составления ОВРСкачать

Примеры для кислой среды
Взаимодействие нитрита натрия с кислотой хлорноватой приводит к получению натрия нитрата и кислоты соляной. Для расстановки коэффициентов используется метод полуреакций, примеры написания уравнений связаны с указанием кислой среды.
ClO3 — + 6H + + 6e — → 3H2O + Cl — |1
3Na + + H + → 3Na + + H +
В данном процессе из нитрита получается нитрат натрия, а из хлорноватой образуется соляная кислота. Окислительная степень азота изменяется с +3 до +5, а заряд хлора +5 становится -1. Оба продукта не образуют осадка.
Видео:11 класс.Элементы 4 периода.Электронные формулы.Скачать

Полуреакции для щелочной среды
Проведение вычислений при избытке гидроксидных ионов соответствует расчетам для кислых растворов. Метод полуреакций в щелочной среде также начинают с выражения составных частей процесса в форме ионных уравнений. Отличия наблюдаются во время выравнивания числа атомарного кислорода. Так, в сторону реакции с его избытком привносят молекулярную воду, а в противоположную часть дописывают анионы гидроксида.
Коэффициент перед молекулой H2O показывает разницу в количестве кислорода после и до стрелки, а для ионов OH — его удваивают. В ходе окисления реагент, выполняющий роль восстановителя, отнимает атомы O от гидроксильных анионов.
Метод полуреакций заканчивается проведением оставшихся этапов алгоритма, которые совпадают с процессами, имеющими кислый избыток. Конечным результатом служит уравнение молекулярного вида.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Примеры для щелочной среды
При смешивании йода с натрия гидроксидом образуется натрия йодид и йодат, молекулы воды. Для получения баланса процесса используют метод полуреакций. Примеры для растворов щелочных имеют свою специфику, связанную с уравниванием атомарного кислорода.
6OH — + I — 5e — → I — + 3H2O + IO3 — |1
I + 5I + 6OH — → 3H2O + 5I — + IO3 —
Результатом реакции является исчезновение фиолетового окрашивания молекулярного йода. Происходит изменение степени окисления данного элемента с 0 до -1 и +5 с образованием йодида и йодата натрия.
Видео:Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Реакции в нейтральной среде
Обычно так называют процессы, проходящие при гидролизе солей с образованием слабокислого (с водородным показателем от 6 до 7) или слабощелочного (с pH от 7 до 8) раствора.
Метод полуреакций в нейтральной среде записывают несколькими вариантами.
В первом способе не учитывают солевой гидролиз. Среду принимают за нейтральную, а слева от стрелочки приписывают молекулярную воду. В таком варианте одну полуреакцию принимают за кислотную, а другую – за щелочную.
Второй способ подходит для процессов, в которых можно установить примерное значение водородного показателя. Тогда реакции для метода ионно-электронного рассматривают в щелочном или кислом растворе.
Видео:Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.Скачать

Пример с нейтральной средой
При соединении сероводорода с натрия дихроматом в воде получается осадок серы, натрия и хрома трехвалентного гидроксиды. Это типичная реакция для нейтрального раствора.
H2S — 2e — → S + H + |3
7H2O +3H2S + Cr2O7 2- → 3H + +3S + 2Cr(OH)3 +8OH — . Катионы водорода и гидроксид-анионы, соединяясь, образуют 6 молекул воды. Их можно убрать в правой и левой части, оставив излишек перед стрелкой.
В конце реакции образуется осадок из гидроксида хрома голубого цвета и желтой серы в щелочном растворе с гидроксидом натрия. Окислительная степень элемента S с -2 становится 0, а хрома заряд с +6 превращается в +3.
Видео:Как расставлять коэффициенты методом электронного баланса при окислении органических веществ?Скачать

Галогены: решение задач методом полуреакций
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом полуреакций разобраны на странице «Метод полуреакций».
Ниже приведены примеры решения задач ОВР галогенов и их соединений в кислотной среде.
Видео:По графику, приведённому на рисунке 6.15, найдите амплитуду ЭДС индукции, период и частоту обращенияСкачать

Уравнения ОВР соединений хлора
Соляная кислота
1. Уравнение реакции меди с кислородом в кислотной среде:
2. Уравнение реакции соляной и селеновой кислот (HCl+H2SeO4):
3. Уравнение реакции соляной кислоты с оксидом свинца (HCl+PbO2):
4. Уравнение реакции соляной кислоты с оксидом марганца (HCl+MnO2):
5. Уравнение реакции соляной кислоты с перманганатом калия (HCl+2KMnO4):
6. Уравнение реакции соляной и ортосурьмяной кислот (HCl+H3SbO3):
7. Уравнение реакции соляной кислоты и гипохлорита кальция (HCl+Ca(ClO)2):
8. Уравнение реакции соляной и хлористой кислот (HCl+HClO2):
9. Уравнение реакции соляной кислоты с гипохлоритом калия (HCl+KClO):
10. Уравнение реакции соляной кислоты с хлоратом калия (бертолетовой солью) (HCl+KClO3):
11. Уравнение реакции соляной и хлорноватой кислот (HCl+HClO3):
12. Уравнение реакции соляной кислоты и оксида хрома (HCl+CrO3):
13. Уравнение реакции соляной кислоты с хроматом калия (HCl+K2CrO4):
14. Уравнение реакции соляной кислоты с дихроматом калия (HCl+K2Cr2O7):
Хлорные кислоты вида HClOn
14. Уравнение реакции хлорноватистой кислоты с пероксидом водорода (HClO+H2O2):
15. Уравнение реакции хлорноватистой кислоты с оксидом азота (HClO+NO):
16. Уравнение реакции разложения хлористой кислоты:
Возможен и такой вариант:
17. Уравнение реакции хлорноватой кислоты с фосфором (HClO3+P):
18. Уравнение реакции хлорноватой кислоты с серебром (HClO3+Ag):
19. Уравнение реакции хлорноватой кислоты с серой (HClO3+S):
20. Уравнение реакции хлорной кислоты с йодом (HClO4+I2):
Хлориды
21. Уравнение реакции хлорида натрия с перманганатом калия (NaCl+KMnO4):
22. Уравнение реакции хлорида натрия с оксидом марганца (NaCl+MnO2):
23. Уравнение реакции хлорида натрия с оксидом свинца (NaCl+PbO2):
24. Уравнение реакции хлорида натрия с хлоратом калия (NaCl+KClO3):
25. Уравнение реакции хлорида калия с оксидом свинца (KCl+PbO2):
26. Уравнение реакции хлорида калия с тетраоксидом трисвинца (KCl+(Pb2Pb)O4):
27. Уравнение реакции хлорида железа с хлоратом калия (FeCl2+KClO3):
28. Уравнение реакции хлорида железа с перманганатом калия (FeCl2+KMnO4):
29. Уравнение реакции хлорида железа с тетраоксидом трисвинца (FeCl2+(Pb2Pb)O4):
30. Уравнение реакции хлорида железа с азотной кислотой (FeCl2+HNO3):
31. Уравнение реакции хлорида стронция с дихроматом калия (SnCl2+K2Cr2O7):
Другие соединения хлора
32. Уравнение реакции гипохлорита кальция с медью (Ca(ClO)2+Cu):
33. Уравнение реакции хлората калия с серной кислотой (KClO3+H2SO4):
34. Уравнение реакции хлората натрия с оксидом серы (NaClO3+SO2):
35. Уравнение реакции перхлората калия с алюминием (KClO4+Al):
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
💥 Видео
Изомеры, гомологи, органическая химияСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Электронные формулы d-элементов. Явление проскока электрона.Скачать

Упражнения на составление формул и названий гомологов и изомеров | Химия 10 класс #5 | ИнфоурокСкачать

Геометрический смысл производной. Уравнение касательнойСкачать