Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Видео:Гидролиз солей. 9 класс.Скачать

Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
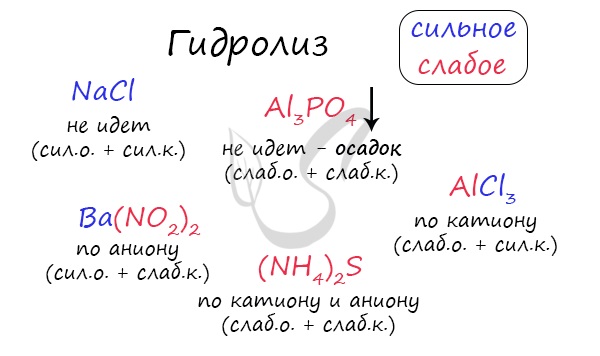
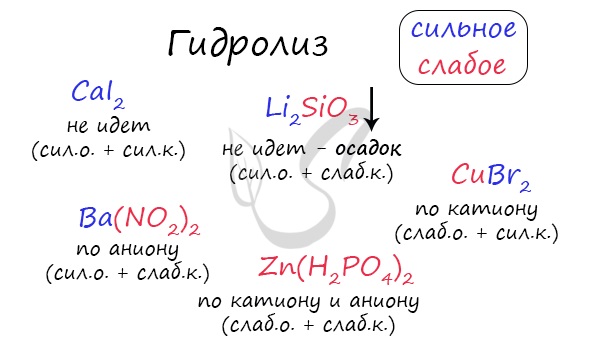
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
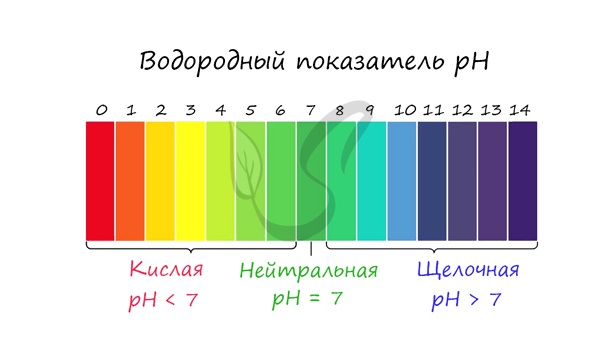
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Составьте уравнение гидролиза солей baso4
Последнее обновление
12 декабря 2021г.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Гидролизом называют реакции обменного взаимодействия вещества с водой, приводящие к их разложению.
Реакции гидролиза можно разделить на обратимые и необратимые.
Необратимому гидролизу по катиону и аниону подвергаются соли образованные слабым нерастворимым основанием и слабой кислотой. В таблице растворимости они отмечаются либо прочерком либо знаком вопроса.
Такая соль не может быть получена в результате реакции обмена:
Необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — нитриды, фосфиды, карбиды, силициды, гидриды.
Чтобы рассматривать обратимый гидролиз необходимо помнить, какие кислоты и основания считаются сильными, а какие — слабыми.
Сильные кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4 (хлорная кислота — соли перхлораты), HClO3 (хлорноватая кислота — соли хлораты)
Сильные основания: LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 — все гидроксиды металлов I и II групп главных подгрупп кроме бериллия и магния
Слабые основания: NH4OH и все нерастворимые основания
Рассмотрим обратимый гидролиз соли сильного основания NaOH и слабой кислоты H2CO3. К аниону слабой кислоты присоединяется ион водорода молекулы воды, а гидроксогруппа остается свободной и обуславливает щелочную реакцию среды.
Такой гидролиз называют гидролизом по аниону
Рассмотрим обратимый гидролиз соли слабого основания Zn(OH)2 и сильной кислоты HCl. К катиону слабого основания присоединяется гидроксид-ион молекулы воды, а ион водорода остается свободным и обуславливает кислую реакцию среды.
Такой гидролиз называют гидролизом по катиону
Рассмотрим обратимый гидролиз соли слабого основания NH4OH и слабой кислоты CH3COOH. К катиону слабого основания присоединяется гидроксид-ион молекулы воды, а ион водорода присоединяется к аниону слабой кислоты. Реакция среды зависит от констант диссоциации слабой кислоты и слабого основания. В данном случае они примерно равны и реакция среды — нейтральная.
Такой гидролиз называют гидролизом по катиону и аниону
Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

НЕ ПОДВЕРГАЮТСЯ ГИДРОЛИЗУ НЕРАСТВОРИМЫЕ СОЛИ.
Например, CaCO3 — карбонат кальция, CuS — сульфид меди (II)
Следует иметь ввиду, что несмотря на то, что мы говорим: соль образована сильным основанием и слабой кислотой или сильной кислотой и слабым основанием реакция среды соли будет слабо щелочной или слабо кислой. Пусть слова «сильная кислота» и «сильное основание» не сбивают вас с толку!
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Примеры заданий.
Выполнение заданий этого типа всегда надо начинать с рассмотрения таблицы растворимости!
1. Установите соответствие между формулой соли и характером среды её разбавленного водного раствора.
ФОРМУЛА СОЛИ
СРЕДА РАСТВОРА
1) нейтральная 2) сильно кислая 3) слабо кислая 4) щелочная
Решение:
В таблице растворимости находим «Р», т.е. все соли растворимы, существуют в водном растворе, следовательно можно определять реакцию среды.
Ca(NO3)2 — соль образована сильным основанием Ca(OH)2 и сильной кислотой HNO3 , значит реакция среды — нейтральная. Ответ 1.
Na2SO3 — соль образована сильным основанием NaOH и слабой кислотой H2SO3 , значит реакция среды — щелочная. Ответ 4.
K3PO4 — соль образована сильным основанием KOH и слабой кислотой H3PO4 , значит реакция среды — щелочная. Ответ 4.
(NH4)2SO4 — соль образована слабым основанием NH4OH и сильной кислотой H2SO4 , значит реакция среды — кислая. Вы должны помнить, что гидролиз в данном случае — обратимая реакция, и количество ионов водорода незначительно, поэтому реакция среды — слабо кислая. Ответ 3.
Общий ответ: 1443
2. Установите соответствие между формулой соли и отношением её к гидролизу.
ФОРМУЛА СОЛИ
А) BaSO4
Б) CuCO3
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону 2) гидролизуется по аниону
3) гидролизуется по катиону и аниону 4) гидролизу не подвергается
Решение:
BaSO4 — в таблице растворимости стоит «Н», т.е. сульфат бария не растворим, в водном растворе практически нет ионов и соль не гидролизуется. Ответ 4.
CuCO3 — в таблице растворимости стоит прочерк «-«, значит в воде соль разлагается, т.е. гидролизуется по катиону и аниону. Ответ 3.
Две оставшиеся соли растворимы «Р».
K2S — соль образована сильным основанием KOH и слабой кислотой H2S , значит гидролизуется по аниону. Ответ 2.
Fe2(SO4)3 — соль образована нерастворимым слабым основанием Fe(OH)3 и сильной кислотой H2SO4 , значит гидролизуется по катиону. Ответ 1.
Общий ответ: 4321
💡 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей.ПримерыСкачать

Мицелла. Агрегат - BaSO4. Стабилизатор - Na2SO4Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

11 класс. Гидролиз солей.Скачать

Константа гидролиза и pH водного раствора солиСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз солей | ХимияСкачать

Гидролиз солейСкачать

СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Необратимый гидролиз. Примеры уравнений с объяснением.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать