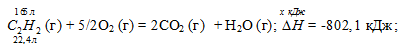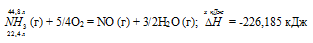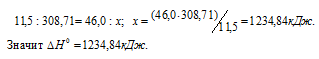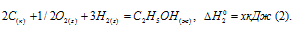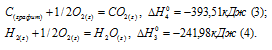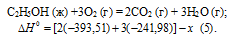Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
8 класс. Практикум по решению задач «Термохимические расчёты»
Задача 1. Определите количество теплоты, которое выделится при образовании
120 граммов оксида магния в результате реакции горения магния, если термохимическое уравнение: 2 Mg + O 2 = 2 MgO + 1204 кДж
Задача 2. В результате реакции, термохимическое уравнение которой
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Задача 4. При сжигании 6,5 г цинка выделилась теплота, равная 34,8 кДж. Составьте термохимическое уравнение реакции.
Задача 5 . Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 7 г железа с серой выделяется 12,15 кДж теплоты.
Задача 6. Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой 2 KClO 3 = 2 KCl + 3 O 2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
Задача 7 . Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 0,5 моль натрия с хлором образуется хлорид натрия и выделяется 205 кДж теплоты.
Задача 8 . Согласно термохимическому уравнению реакции
определите количество теплоты, выделившейся при сжигании 24 г метана.
Задача 9 . Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
Задача 10 . Составьте термохимическое уравнение реакции, если известно, что при сгорании 20 г водорода в кислороде выделяется 2860 кДж теплоты.
Задача 11 . По термохимическому уравнению H 2 + Cl 2 = 2 HCl + 184,36 кДж
рассчитайте, какой объем водорода затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
Задача 12 . Дано термохимическое уравнение: 3Н 2 + N 2 = 2 N Н 3 + 92 кДж, выделилось 23 кДж теплоты. Чему равен объём полученного (при н.у.) аммиака ?
Задача 13 . Дано термохимическое уравнение: 2 S О 2 + О 2 = 2 S О 3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса оксида серы ( IV ) (в граммах) прореагировала с кислородом?
Задача 14 . В результате реакции, термохимическое уравнение которой
2 SO 2 + О 2 = 2 S О 3 + 198 кДж, выделилось 297 кДж теплоты. Вычислите объем израсходованного оксида серы (1 V ).
Задача 15 . В реакции, протекающей в соответствии с термохимическим уравнением: 2М g + O 2 = 2М g О + 1204 кДж, выделилось 1806 кДж теплоты. Чему равна масса вступившего в реакцию магния ?
Задача 16 . Дано термохимическое уравнение: 2М g + O 2 = 2М g О + 1204 кДж. В результате реакции выделилось 903 кДж теплоты. Какая масса магния (в граммах) сгорела?
Задача 17 . В соответствии с термохимическим уравнением реакции
2Са + О 2 = 2СаО + 635,1 кДж
Определите количество теплоты, выделяющееся при горении 10 г кальция.
Задача 18 . В реакцию, протекающую в соответствии с термохимическим уравнением 4 Li + 2 O 2 = 2 Li 2 O + 1198кДж, вступило 1 моль лития. Вычислите количество выделившейся теплоты.
Задача 19 . Термохимическое уравнение реакции: 4А1+3О 2 =2А1 2 О 3 + 3350 кДж. Вычислите количество теплоты, выделившееся при окислении 54 г алюминия,
Задача 20. Дано термохимическое уравнение: 2 F еО + С = 2 F е + СО 2 — 132 кДж.
В результате реакции поглотилось 55 кДж теплоты. Какая масса оксида железа (П) в граммах прореагировала с углеродом?
Задача 21 . Дано термохимическое уравнение: 2 N О + О 2 = 2 N О 2 + 114 кДж. Сколько теплоты (в кДж) выделится при взаимодействии 100 г оксида азота ( II ) с избытком кислорода?
Задача 22 . В реакцию, протекающую в соответствии с термохимическим уравнением 2А1 + 3 S = А l 2 S 3 + 509 кДж, вступило 108 г алюминия. Чему равно количество выделившейся теплоты?
Задача 23. При соединении 4,2 г железа с серой выделилось 7,15 кДж теплоты. Составьте термохимическое уравнение реакции.
Задача 24. Термохимическое уравнение реакции: 4Р + 5О 2 = 2Р 2 О 5 + 3010 кДж. Сколько теплоты выделится при сгорании 310 г фосфора?
Задача 25 . В соответствии с термохимическим уравнением
выделится 1505 кДж. Какая масса фосфора для этого потребуется ?
Задача 26 . Вычислите по термохимическому уравнению: С + O 2 = CO 2 + 402 кДж
сколько грамм углерода сгорело, если выделилось 2412 кДж теплоты.
Задача 27 . В результате реакции, термохимическое уравнение которого С (графит) + О 2(г) = СО 2(г) + 393,5 кДж, выделилось 1967,5 кДж теплоты. Объем (н.у.) образовавшегося при этом углекислого газа равен чему ?
Курс повышения квалификации
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Задачи. Термохимические расчёты. 6 Дано термохимическое уравнение: 3Н 2 + N
- Главная > Документ
- Составление термохимического уравнения реакции и вычисление теплот образования веществ
- Теплота образования веществ
- Теплота образования
- Тепловой эффект реакции
- Термохимическое уравнение реакции
- 💡 Видео
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 864 человека из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 48 человек из 23 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 39 человек из 23 регионов
«Профессиональный имидж педагога: стереотипы и методы их преодоления»
Свидетельство и скидка на обучение каждому участнику
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 839 163 материала в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 11.06.2016
- 1037
- 8
- 11.06.2016
- 793
- 0
- 11.06.2016
- 1135
- 6
- 11.06.2016
- 359
- 0
- 11.06.2016
- 547
- 0
- 11.06.2016
- 850
- 5
- 10.06.2016
- 948
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 11.06.2016 15965
- DOCX 40.5 кбайт
- 219 скачиваний
- Рейтинг: 3 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Афанасьева Татьяна Алексеевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 9 месяцев
- Подписчики: 2
- Всего просмотров: 294124
- Всего материалов: 69
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
В Госдуме предложили унифицировать школьные программы
Время чтения: 1 минута
«Единая Россия» внесла в Госдуму проект о снятии излишней нагрузки с учителей
Время чтения: 2 минуты
Около 20% детей до 15 лет не воспринимают прочитанную информацию
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Задачи. Термохимические расчёты. 6 Дано термохимическое уравнение: 3Н 2 + N
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
A 30. Задачи. Термохимические расчёты.
6-1. Дано термохимическое уравнение: 3Н 2 + N 2 = 2NН 3 + 92 кДж, выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака равен…
6-2. Дано термохимическое уравнение: 2SО 2 + О 2 = 2SО 3 + 198 кДж. В результате реакции выделилось 495 кДж теплоты. Какая масса оксида серы (IV) (в граммах) прореагировала с кислородом?
6-3. В результате реакции, термохимическое уравнение которой 2SO 2 + О 2 = 2SО 3 + 198 кДж,
выделилось 297 кДж теплоты. Объем израсходованного оксида серы (1V) равен…
6-4. В реакции, протекающей в соответствии с термохимическим уравнением:
2Мg +O 2 = 2МgО + 1204 кДж, выделилось 1806 кДж теплоты. Масса вступившего в реакцию магния равна…
6-5. Дано термохимическое уравнение: 2Мg + O 2 = 2МgО + 1204 кДж. В результате реакции выделилось 903 кДж теплоты. Какая масса магния (в граммах) сгорела?
6-6. В соответствии с термохимическим уравнением реакции 2Са + О 2 = 2СаО + 635,1 кДж
количество теплоты, выделяющееся при горении 10 г кальция, равно…
6-7. В реакцию, протекающую в соответствии с термохимическим уравнением
4Li + 2O 2 = 2Li 2 O + 1198кДж, вступило 1 моль лития. Количество выделившейся теплоты равно …
6-8. При сжигании 6,5 г цинка выделилась теплота, равная 34,8 кДж. Составьте термохимическое уравнение реакции.
6-9.Термохимическое уравнение реакции: 4А1+3О 2 =2А1 2 О 3 + 3350 кДж. Количество теплоты, выделившееся при окислении 54 г алюминия, равно…
6-10. Теплота образования оксида алюминия равна 1676 кДж/моль. Определите тепловой эффект реакции, в которой при взаимодействии алюминия с кислородом получено 25,5 г А1 2 О 3 .
6-11. Теплота образования оксида меди (II) равна 156 кДж/моль. Количество теплоты, выделившееся при окислении 32 г меди, равно…
6-12. Дано термохимическое уравнение: 2FеО + С = 2Fе + СО 2 — 132 кДж. В результате реакции поглотилось 55 кДж теплоты. Какая масса оксида железа (П) в граммах прореагировала с углеродом?
6-13. Дано термохимическое уравнение: 2NО + О 2 = 2NО 2 + 114 кДж. Сколько теплоты (в кДж) выделится при взаимодействии 100 г оксида азота (II) с избытком кислорода?
6-14. В реакцию, протекающую в соответствии с термохимическим уравнением
2А1 + 3S = Аl 2 S 3 + 509 кДж, вступило 108 г алюминия. Количество выделившейся теплоты равно…
6-15. Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 7 г железа с серой выделяется 12,15 кДж теплоты.
6-16. При соединении 4,2 г железа с серой выделилось 7,15 кДж теплоты. Составьте термохимическое уравнение реакции.
6-17. Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 0,5 моль натрия с хлором образуется хлорид натрия и выделяется 205 кДж теплоты.
6-18.Термохимическое уравнение реакции: 4Р + 5О 2 = 2Р 2 О 5 + 3010 кДж. Сколько теплоты выделится при сгорании 310 г фосфора?
6-19. В соответствии с термохимическим уравнением 4Р + 5О 2 = 2Р 2 О 5 + 3010 кДж
1505 кДж выделится при сгорании фосфора массой
6-20. При сжигании 64 г серы выделилось 594 кДж теплоты. Теплота образования сернистого газа равна . кДж/моль.
6-21. Вычислите по термохимическому уравнению: С + O 2 = CO 2 + 402 кДж
сколько грамм углерода сгорело, если выделилось 2412 кДж теплоты.
6-22. В результате реакции, термохимическое уравнение которого С (графит) + О 2(г) = СО 2(г) + 393,5 кДж, выделилось 1967,5 кДж теплоты. Объем (н.у.) образовавшегося при этом углекислого газа равен…
6-23. Составьте термохимическое уравнение реакции, если известно, что при сгорании 20 г водорода в кислороде выделяется 2860 кДж теплоты.
6-24. Путем сжигания серы получено 3,2 г оксида серы (IV) и при этом выделилось 14,6 кДж теплоты. Составьте термохимическое уравнение реакции.
6-25. Вычислите по термохимическому уравнению реакции: СаСО 3 = CaO + CO 2 – 157 кДж
количество теплоты, требующееся для разложения 1 кг известняка.
6-26. При растворении цинка в серной кислоте выделилось 4 г водорода и 305 кДж. Определить, сколько теплоты выделится при растворении 97 г цинка.
6-27. В соответствии с термохимическим уравнением реакции 2 CO(г) = СO 2 (г) + С(тв) + 173 кДж выделилось 1730 кДж теплоты. Объем оксида углерода (II) (н.у.), вступившего в реакцию, равен
6-28. В результате реакции, термохимическое уравнение которой
2АgNО 3 (тв) = 2Аg (тв) +2NO 2 (г) + О 2 (г) — 317 кДж, поглотилось 15,85 кДж теплоты. Масса выделившегося серебра равна…
6-29. В результате реакции, термохимическое уравнение которой 4NН 3(г) +5O 2(г) = 4NО (г) +6Н 2 О (г) + 902 кДж, выделилось 1127,5 кДж теплоты. Объем (н.у.) образовавшегося при этом оксида азота (П) равен…
6-30. В результате реакции, термохимическое уравнение которой NH 4 NO 2 = N 2 + 2Н 2 O + 316 кДж,
выделилось 948 кДж теплоты. Масса разложившейся соли равна…
6-31. В результате реакции, термохимическое уравнение которой 2КСlО 3 = 2КСl + 3O 2 + 91 кДж,
выделилось 182 кДж теплоты. Масса образовавшегося кислорода равна…
6-32. Теплота образования сульфида натрия равна 372 кДж/моль. Количество теплоты, образующееся при взаимодействии 230 г натрия с избытком серы, равно..
6-33. При взаимодействии 5,6 л (и.у.) фтора, с избытком лития выделилось 308 кДж теплоты. Теплота образования фторида лития равна. кДж/моль.
6-34. При окислении 80 г кальция выделилось 1270 кДж теплоты. Теплота образования оксида кальция равна . кДж/моль.
6-35. При сжигании 1 моль ацетилена выделяется 1350 кДж теплоты. Сколько теплоты выделяется при сжигании 2 м 3 ацетилена?
6-36. Теплота сгорания ацетилена равна 1350 кДж/моль. Какое количество теплоты выделится при сгорании ацетилена объемом 1 л (в пересчете на н.у.)?
6-37. На основании термохимического уравнения реакции полного сгорания ацетилена
2С 2 Н 2 + 5О 2 = 4СО 2 + 2Н 2 О + 2700 кДж рассчитайте, сколько теплоты выделится, если будет израсходовано: а) 13 г ацетилена; б) 0,5 моль ацетилена; в) 100 м 3 ацетилена.
6-38.Термохимическое уравнение реакции горения ацетилена: 2С 2 Н 2 + 5О 2 =4СО 2 +2Н 2 О +2700 кДж. Сколько теплоты выделится при сгорании 58 г ацетилена?
6-39. В результате реакции, термохимическое уравнение которой 2С 2 Н 2 +5О 2 =4СО 2 +2Н 2 О +2700 кДж, выделилось 650 кДж теплоты. Объем сгоревшего ацетилена равен…
6-40. На основании термохимического уравнения реакции горения этилена
С 2 Н 4 +3О 2 =2СО 2 + 2Н 2 О + 1400 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило: а) 1моль кислорода; б) 336 м 3 кислорода; в)50 м3 этилена.
6-41. На основании термохимического уравнения реакции горения метана
СН 4 +2О 2 =СО 2 + 2Н 2 О + 890 кДж рассчитайте, какой объем метана надо сжечь, чтобы получить 4,45∙10 5 кДж энергии.
6-42. Согласно термохимическому уравнению реакции СН 4 + 2О 2 = СО 2 + 2Н 2 О + 802 кДж,
количество теплоты, выделившейся при сжигании 24 г метана, равно…
6-43. Найти тепловой эффект реакции горения метана, если при сгорании 0,1 моль его выделяется 89,3 кДж теплоты.
6-44. При горении 26 г метана в кислороде с образованием углекислого газа и воды выделяется 891 кДж теплоты. Составьте термохимическое уравнение реакции и найдите, сколько теплоты выделится при сгорании 2,7 моль метана.
6-45. В соответствии с термохимическим уравнением С 6 Н 12 О 6 + 6O 2 = 6СО 2 + 6Н 2 O + 2816 кДж
выделится 1408 кДж теплоты, если в реакции участвует кислород количеством вещества…
6-46. В соответствии с термохимическим уравнением реакции С 6 Н 12 О 6 + 6O 2 = 6СО 2 + 6Н 2 O + 2816 кДж
140 кДж теплоты выделяется при сгорании глюкозы массой…
6-47. В результате реакции, термохимическое уравнение которой С 2 Н 5 ОН+3О 2 =2СO 2 +3Н 2 О +1374 кДж, выделилось 687 кДж теплоты. Количество вещества этанола равно…
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Составление термохимического уравнения реакции и вычисление теплот образования веществ
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
💡 Видео
7. Решение задач по химическим уравнениям. Как найти массу, объем и количество вещества по реакции?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Химия | Задачи на термохимиюСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Моль. Молярная масса. Решение задач по химии. Часть 1.Скачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать