Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Составьте молекулярное уравнение реакции железа с кислородом с образованием магнетита впр
1) Составьте молекулярное уравнение реакции железа с кислородом с образованием гематита.
2) Укажите, является ли эта реакция окислительно-восстановительной или она протекает без изменения степеней окисления.
Прочитайте следующий текст и выполните задания 5—7.
Металл железо известен человеку ещё с глубокой древности. Использовать изделия из него начали ещё в начале 1-го тысячелетия до н. э. В Древнем Египте железо называли «небесный металл», его древнегреческое название означает «звёздный», а древнеримское переводится как «капнувший с неба». Такое название металла объяснялось очень просто: в древности люди не умели добывать соединения железа и получать из них металл, а использовали только метеоритное железо, то есть буквально железо, упавшее с неба. Широкое использование железа не прекращается и в настоящее время. Известно, что в самородном виде в природе железо практически не встречается, однако его соединения, такие как гематит , магнетит
и пирит, широко распространены. Из этих соединений металл и получают в настоящее время. Один из способов получения железа заключается в восстановлении его оксида под действием оксида углерода (II)
при высокой температуре. В чистом виде железо представляет собой серебристо-серый тугоплавкий металл, обладающий превосходными механическими свойствами: большой прочностью и способностью прокатываться, протягиваться и штамповаться. В основном этот металл используют в виде сплавов — чугуна, стали и др. Взаимодействие железа и оксидов железа с кислотами (например,
) приводит к образованию солей, которые также широко применяются. Так, например хлорид железа (III)
используется при окрашивании тканей, при производстве красящих пигментов, в качестве коагулянта при очистке воды. Сульфат железа (II)
используется при окрашивании ткани и шерсти, в сельском хозяйстве и в медицине. При взаимодействии сульфата железа (II) с гидроксидом калия
образуется гидроксид железа (II)
. Это соединение используется при изготовлении железо-никелевых аккумуляторов.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота .
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является хлорид железа (III) .
Ответ: Оксид — , основание —
, кислота —
, соль —
.
Возможны также другие варианты ответа для граф «оксид» , «основание»
, «кислота»
и «соль»
.
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

ВПР по химии 11 класс
Всероссийская проверочная работа по химии.
Просмотр содержимого документа
«ВПР по химии 11 класс»
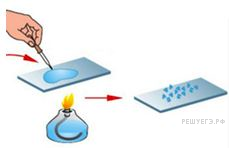
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) смеси железного и алюминиевого порошка;
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Способ разделения смеси
Смеси железного и алюминиевого порошка
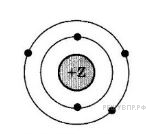
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Ответы запишите в таблицу.
Периодическая система химических элементов Д. И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Например, известно, что с увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах — уменьшается.
Учитывая эти закономерности, расположите в порядке уменьшения электроотрицательности следующие элементы: 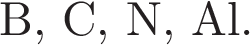
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние;
— имеют низкие значения температур кипения и плавления;
— имеют низкую теплопроводность
— твёрдые при обычных условиях;
— в расплавах и растворах проводят
Используя данную информацию, определите, какое строение имеют вещества йодоводород 
кальция
Запишите ответ в отведённом месте:
1) йодоводород 
2) карбонат кальция 
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Металл железо известен человеку ещё с глубокой древности. Использовать изделия из него начали ещё в начале 1-го тысячелетия до н. э. В Древнем Египте железо называли «небесный металл», его древнегреческое название означает «звёздный», а древнеримское переводится как «капнувший с неба». Такое название металла объяснялось очень просто: в древности люди не умели добывать соединения железа и получать из них металл, а использовали только метеоритное железо, то есть буквально железо, упавшее с неба. Широкое использование железа не прекращается и в настоящее время. Известно, что в самородном виде в природе железо практически не встречается, однако его соединения, такие как гематит 







1) Составьте молекулярное уравнение реакции железа с кислородом с образованием гематита.
2) Укажите, является ли эта реакция окислительно-восстановительной или она протекает без изменения степеней окисления.
1) Составьте молекулярное уравнение упомянутой в тексте реакции между сульфатом железа (II) и гидроксидом калия.
2) Укажите признак реакции, протекающей между сульфатом железа (II) и гидроксидом калия.
При исследовании минерализации бутилированной воды в ней были обнаружены следующие анионы: , , . Для проведения качественного анализа к этой воде добавили раствор .
1. Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа).
2. Запишите сокращённое ионное уравнение протекающей химической реакции.
Дана схема окислительно-восстановительной реакции:
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице классам/группам органический соединений. Запишите номера этих веществ в соответствующие графы таблицы.
В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого выше перечня, и расставьте коэффициенты.
Изопропиловый спирт благодаря низкой токсичности используется в качестве растворителя в косметике, парфюмерии, бытовой химии, в средствах для очистки стёкол, оргтехники и т. п. Изопропиловый спирт можно получить в соответствии с приведённой схемой превращений:
Выберите из предложенного перечня вещество Х и запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ. Запишите название вещества Х.
Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК — это такая концентрация вредного вещества в окружающей среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК акролеина в воздухе рабочей зоны составляет 0,2 мг/м 3 .
В рабочем помещении одного из ресторанов быстрого питания площадью 32 м 2 и высотой потолка 3,2 м в процессе длительной тепловой обработки жира в воздух выделилось 25,6 мг акролеина. Определите и подтвердите расчётами, превышает ли концентрация акролеина в воздухе данного помещения значение ПДК. Предложите способ, позволяющий снизить концентрацию акролеина в помещении.
Раствор формальдегида зачастую используют в медицине как антисептик. Чему равен объём (н. у.) формальдегида, который потребуется для получения 1 л формалина ( = 1,11 г/мл) с массовой долей формальдегида 10%? (Ответ дайте с точностью до десятых).
🔍 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Составление уравнений реакций горения. 11 класс.Скачать

ЖЕЛЕЗО и его соединения для ЕГЭ ПОЛНОСТЬЮ | Самые завальные реакции | ЕГЭ по химии 2023Скачать

25. Схема реакции и химическое уравнениеСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции ионного обмена. 9 класс.Скачать

9 и 11 класс. Железо. Часть 1.Скачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

Разрушение комплексов с образованием осадковСкачать

Классификация реакций: ионные и радикальные реакцииСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

Скорость химических реакций. 9 класс.Скачать

75. Ионные реакции в растворах электролитовСкачать