1) Составьте молекулярное уравнение реакции нитрата железа (III) c гидроксидом натрия, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции.
Прочитайте следующий текст и выполните задания 5—7.
Железо — один из самых широко используемых в производстве металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Свойства соединений железа в значительной степени зависят от степени окисления железа. Так, в степени окисления +3 железо образует амфотерный оксид , который реагирует с раствором азотной кислоты
с образованием нитрата железа (III)
. Для качественного определения солей железа (III) можно использовать раствор гидроксида натрия
, так как в результате этой реакции выпадает осадок бурого цвета.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить азотная кислота .
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является карбонат железа (II) .
Ответ: Оксид — , основание —
, кислота —
, соль —
.
Возможны также другие варианты ответа для графы «соль» ().
- Реальный вариант ОГЭ по химии — 2021 № 6
- Нитрат железа(3) + гидроксид калия уравнение реакции?
- Напишите уравнение реакции между растворами нитрата железа (3) и гидроксида калия в молекулярной полной и следущих ионных формах?
- Составить молекулярные, полные и сокращённые ионные уравнения следующих реакций : нитрата кальция и карбоната калия, азотной кислоты и гидроксида бария, гидроксида натрия и нитрата железа(II)?
- Составьте уравнение химической реакции ?
- Составьте молекулярное и ионное уравнение реакций гидроксида калия и нитрата меди 2?
- Напишите уравнение реакции между растворами нитрата железа ( III) и гидроксида калия в молекулярной, полной и сокращенной ионных формах?
- Составте уравнение реакции между растворами гидроксида калия и нитрата меди(2)?
- Напишите уравнение реакции между растворами нитрата цинка и гидроксида калия?
- Составьте уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде между веществами : а) хлорид цинка и фосфат натрия ; б) силикат калия и нитрат бария ; в) нитрат железа (III) и гидр?
- ПОМОГИТЕ?
- Напишите уравнения реакций при помощи которых можно осуществлять цепочку превращений калий — гидроксид калия — хлорид калия — нитрат калия — сульфат калия — нитрат калия?
- 💡 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реальный вариант ОГЭ по химии — 2021 № 6
Реальный вариант ОГЭ по химии-2021. Реальный КИМ ОГЭ по химии 2021 с ответами и решениями.
В 2021 году централизованный ОГЭ по химии отменили. Вместо этого провели контрольные работы в формате ОГЭ. Но КИМ остались те же самые (не пропадать же им).
Часть 1
| Ответами к заданиям 1–17 являются цифра или последовательность цифр (чисел). Ответы сначала укажите в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки, без пробелов, запятых и других дополнительных символов . Каждую цифру пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. |
1. Выберите два утверждения, в которых говорится о кальции как о простом веществе:
1) Кальций получают электролизом расплавов солей.
2) В природе кальций встречается в виде шести изотопов.
3) В состав зубной пасты входит кальций.
4) Кальций — серебристо-серый металл, но на воздухе он быстро темнеет.
5) Кальций входит в состав таких минералов, как гипс, алебастр, известняк.
Запишите номера выбранных ответов.
2. На рисунке изображена модель строения ядра атома некоторого химического элемента
Запишите в таблицу номер периода (Х), в котором данный химический элемент расположен в Периодической системе Д.И. Менделеева, и величину заряда ядра (Y) его атома. (Для записи ответа используйте арабские цифры.)
3. Расположите химические элементы
1) фтор 2) йод 3) бром
в порядке увеличения кислотности образуемых ими летучих водородных соединений.
Запишите указанные номера элементов в соответствующем порядке.
4. Установите соответствие между формулой соединения и степенью окисления хрома в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой:
| ФОРМУЛА СОЕДИНЕНИЯ | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА |
| А) CrCO3 | 1) +6 |
| Б) Cr(NO3)2 | 2) +2 |
| В) Cr2O3 | 3) +3 |
| 4) +4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5. Из предложенного перечня выберите два вещества с ковалентной неполярной связью.
Запишите номера выбранных ответов.
6. Какие два утверждения верны для характеристики как лития, так и калия
1) Соответствующее простое вещество является неметаллом.
2) На внешнем энергетическом уровне в атоме находится один электрон.
3) Электроны в атоме расположены на трёх электронных слоях.
4) Значение электроотрицательности больше, чем у водорода.
5) Химический элемент образует высший оксид состава Э2О
Запишите номера выбранных ответов
7. Из предложенного перечня веществ выберите оснóвный оксид и основание.
Запишите в поле ответа сначала номер оснóвного оксида, а затем номер основания.
8. Какие два из перечисленных веществ вступают в реакцию с оксидом фосфора(III)?
Запишите номера выбранных ответов.
9. Установите соответствие между реагирующими веществами и продуктом(-ами) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) ВЗАИМОДЕЙСТВИЯ |
| А) KOH и HNO3 | 1) H3PO4 |
| Б) KOH и N2O5 | 2) KNO3 и H2O |
| В) P2O5 и H2O | 3) H3PO3 |
| 4) KNO2 и H2O2 | |
| 5) KNO2 и H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) O2 | 1) H2O, CO |
| Б) Fe2O3 | 2) HNO3, C |
| В) H2SO4(разб.) | 3) FeS, CH4 |
| 4) Cu(OH)2, Mg |
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите две окислительно — восстановительные реакции.
1) взаимодействие оксида цинка и гидроксида калия
2) взаимодействие оксида серы(IV) и киcлорода
3) взаимодействие кальция и серы
4) разложение гидроксида алюминия
5) разложение карбоната магния
Запишите номера выбранных ответов.
12. Установите соответствие между веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) K2SiO3 и H2SO4 | 1) выделение газа |
| Б) Cu(OH)2 и HNO3 | 2) образование осадка |
| В) Na3PO4 и AgNO3 | 3) растворение осадка |
| 4) видимые признаки реакции отсутствуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
13. При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль ионов?
1) хлорид железа (II)
2) фторид аммония
3) нитрат кальция
4) сульфат лития
5) гидроксид натрия
Запишите номера выбранных ответов.
14. Выберите два исходных вещества, взаимодействию которых соответствует сокращенное ионное уравнение реакции.
Запишите номера выбранных ответов.
15. Установите соответствие между схемой процесса, происходящего в окислительно — восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую
позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) N +5 → N -3 | 1) окисление |
| Б) Mn +4 → Mn +6 | 2) восстановление |
| В) O2 0 → 2O -2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
16. Из перечисленных суждений о правилах работы с веществами и оборудованием в лаборатории и быту выберите верное (-ые) суждение(-я).
1) В химической лаборатории запрещается принимать пищу.
2) При проведении реакций между растворами медного купороса и щелочи необходимо надеть защитные очки.
3) При работе с раствором питьевой соды необходимо использовать резиновые перчатки.
4) Перемешивание растворов, находящихся в пробирке, осуществляют легким постукиванием пальца по её нижней части.
Запишите в поле ответа номер(а) верного(-ых) суждения(-й).
17. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) AlCl3 и BaBr2 | 1) HNO3 |
| Б) K2SO4 и NaCl | 2) Ba(NO3)2 |
| В) K2SO4 и (NH4)2SO4 | 3) NaOH |
| 4) Cu |
| Ответом к заданиям 18, 19 является целое число или конечная десятичная дробь. Ответы сначала укажите в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно. |
| Задания 18 и 19 выполняются с использованием следующего текста. |
| Стекло — один из самых древних материалов. Исследованием стекла и способами изготовления различных видов стекла занимался Михаил Васильевич Ломоносов. Им был предложен метод получения стекла, который заключался в плавления смеси кварцевого песка, соды (карбоната натрия) и известняка (карбоната кальция). В результате получилось вещество состава Na2CaSi6O14, которое можно представить как соединение оксидов: Na2O · CaO · 6SiO2. |
18. Вычислите массовую долю (в процентах) кальция в стекле указанного состава. Запишите число с точностью до десятых.
19. Какая масса (в граммах) кальция содержится в 775 г стекла, состав которого указан в тексте? Запишите число с точностью до десятых.
| Не забудьте перенести все ответы в бланк ответов №1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания. |
| Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый ответ к нему. Ответы записывайте чётко и разборчиво. |
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель.
HNO3 окислитель за счет N +5
PbS — восстановитель за счет S -2
21. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
22. К избытку раствора сульфата меди(II) добавили 10 г раствора c массовой долей гидроксида натрия 20%, Вычислите массу образовавшегося осадка. В ответе запишите уравнение реакции, о которой идёт речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
n(NaOH) = 2/40 = 0,05 моль
n(Cu(OH)2) = 1/2*n(NaOH) = 0,025 моль
m(Cu(OH)2) = 0,025 * 98 = 2,45 г
Практическая часть
| Прочитайте текст и выполните задания 23 и 24. Для ответа на задание 23 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (23), а затем развёрнутый ответ к нему. Ответ записывайте чётко и разборчиво. Задание 24 выполняйте только под наблюдением экспертов. При выполнении задания 24 или сразу после выполнения можно делать записи в черновике, после чего вернуться к выполнению письменной части экзаменационной работы до момента окончания экзамена. |
| Дан раствор сульфата цинка, а также набор следующих реактивов: соляная кислота, растворы хлорида железа(III), гидроксида калия, нитрата бария, сульфата алюминия. |
23. Запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата цинка, и укажите признаки их протекания. Используйте только вещества из приведенного выше перечня.
ZnSO4 + 2KOH = Zn(OH)2 ↓ + K2SO4 образование белого осадка
| Ознакомьтесь с инструкцией по выполнению задания 24, прилагаемой к заданиям КИМ. Сообщите организатору в аудитории о своей готовности приступить к выполнению задания 24. Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. |
24. Проведите химические реакции между сульфатом цинка и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведенные в инструкции
к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Инструкция по выполнению задания 24
| Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории. 1. Вы приступаете к выполнению задания 24. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории. Видео:Реакция нитрата железа 3 с раствором аммиака (гидроксид аммония)Скачать  Нитрат железа(3) + гидроксид калия уравнение реакции?Химия | 5 — 9 классы Нитрат железа(3) + гидроксид калия уравнение реакции. Fe(NO3)3 + 3KOH = Fe(OH)3 + 3KNO3 Fe(3 + ) + 3 OH( — ) = Fe(OH)3 осадок бурого цвета. Видео:Взаимодействие хлорида железа III с роданидом калияСкачать  Напишите уравнение реакции между растворами нитрата железа (3) и гидроксида калия в молекулярной полной и следущих ионных формах?Напишите уравнение реакции между растворами нитрата железа (3) и гидроксида калия в молекулярной полной и следущих ионных формах. Видео:Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать  Составить молекулярные, полные и сокращённые ионные уравнения следующих реакций : нитрата кальция и карбоната калия, азотной кислоты и гидроксида бария, гидроксида натрия и нитрата железа(II)?Составить молекулярные, полные и сокращённые ионные уравнения следующих реакций : нитрата кальция и карбоната калия, азотной кислоты и гидроксида бария, гидроксида натрия и нитрата железа(II). Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать  Составьте уравнение химической реакции ?Составьте уравнение химической реакции ! И укажите тип реакций ( Желательно роставить коэффициенты! ) Гидроксид Железа (III) Гидроксид калия + ортофосфорная кислота Оксид железа + кислород Железо + Нитрат меди Магний + фосфор Карбонат калия. Видео:Взаимодействие хлорида железа (III) с гидроксидом натрия I ЕГЭ по химииСкачать  Составьте молекулярное и ионное уравнение реакций гидроксида калия и нитрата меди 2?Составьте молекулярное и ионное уравнение реакций гидроксида калия и нитрата меди 2. Видео:Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать  Напишите уравнение реакции между растворами нитрата железа ( III) и гидроксида калия в молекулярной, полной и сокращенной ионных формах?Напишите уравнение реакции между растворами нитрата железа ( III) и гидроксида калия в молекулярной, полной и сокращенной ионных формах. Видео:Разложение нитрата калия при нагревании. Реакция нитрата калия с углем - 9 - 11 классСкачать  Составте уравнение реакции между растворами гидроксида калия и нитрата меди(2)?Составте уравнение реакции между растворами гидроксида калия и нитрата меди(2). Видео:Химия ОГЭ 2022 / Полный разбор варианта / Вариант 7Скачать  Напишите уравнение реакции между растворами нитрата цинка и гидроксида калия?Напишите уравнение реакции между растворами нитрата цинка и гидроксида калия. Разобрать как РИО. Видео:Получение нитрата железа(железо азотнокислое)Скачать  Составьте уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде между веществами : а) хлорид цинка и фосфат натрия ; б) силикат калия и нитрат бария ; в) нитрат железа (III) и гидр?Составьте уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде между веществами : а) хлорид цинка и фосфат натрия ; б) силикат калия и нитрат бария ; в) нитрат железа (III) и гидроксид калия. Видео:Качественная реакция на ион трехвалентного железаСкачать  ПОМОГИТЕ?Составьте уравнение реакции 1) нитрата железа (III) с гидроксидом калия 2) распишите с точки зрения ионного обмена. Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Напишите уравнения реакций при помощи которых можно осуществлять цепочку превращений калий — гидроксид калия — хлорид калия — нитрат калия — сульфат калия — нитрат калия?Напишите уравнения реакций при помощи которых можно осуществлять цепочку превращений калий — гидроксид калия — хлорид калия — нитрат калия — сульфат калия — нитрат калия. Перед вами страница с вопросом Нитрат железа(3) + гидроксид калия уравнение реакции?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 5 — 9 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы. N = m / M m = n * M m (Na2O) = 1, 5 моль * 62 г / моль = 93 г. Считаем конечную массу раствора m = 125 + 50 = 175 г Считаем массу кислоты в первом растворе m = w * m(раствора) = 0. 12 * 50 = 6 г Масса кислоты не менялась Считаем массовую долю кислоты в конечном растворе w = m(H2SO4) / m(раствора) = 6 / 175 = 0. MgSO4 + 2KOH — — >Mg(OH)2↓ + K2SO4 Mg⁺² + SO⁻²₄ + 2K⁺ + 2OH⁻ — — >Mg(OH)2↓ + 2K⁺ + SO⁻²₄ Mg⁺² + 2OH⁻ — — >Mg(OH)2↓ AgNO3 + HCL — — >AgCL↓ + HNO3 Ag⁺ + NO⁻₃ + H⁺ + CL⁻ — — >AgCL↓ + H⁺ + NO⁻₃ Ag⁺ + CL⁻ — — >AgCL↓ FeS + 2HCL — — >H2S↑ + FeCL2 Fe⁺² + S⁻².. А) MgSo4 + 2KOH = Mg(OH)2↓ + K2SO4 б)AgNO3 + HCl = AgCl↓ + HNO3 в)FeS + 2HCl = FeCl2 + H2S↑ г)Ba(OH)2 + FeSO4 = Fe(OH)2↓ + BaSO4↓. Могу лишь написать их образование и среду, может чем — то поможет : 1. BaSO4 образован сильным основанием Ва(ОН)2 и сильной кислотой H2SO4, среда нейтральная, гидролизу не подвергается. 2. MgCO3 образован слабым основанием Mg(OH)2 и слабой кислотой.. Реакция электролиза хлорида калия : 2KCl = 2K + Cl2⬆️ Масса примесей : m(прим. ) = 150г * 0, 1 = 15 г Масса чистого хлорида калия : m (KCl) = 150г — 15г = 135г Масса калия : m(K) = (40 г / моль * 2 * 135г) : (75, 5 г / моль * 2) = 68, 79г. Мед — ? 25×100 = 2500 2500÷6. 25 = 400 руд. У них у всех не металлическое а все остальное есть в табл. Менделеева. Ответ : Li, K, C, N, P, S, Cl. CH₄ + Cl₂ → CH₃Cl + HCl 2CH₃Cl + 2Na → CH₃ — CH₃ + 2NaCl CH₃ — CH₃ + Br₂ → CH₃ — CH₂Br + HBr 2CH₃ — CH₂Br + 2Na → CH₃ — CH₂ — CH₂ — CH₃ + 2NaBr. 💡 ВидеоОГЭ 2020 по химии, тренировочный вариант №3Скачать 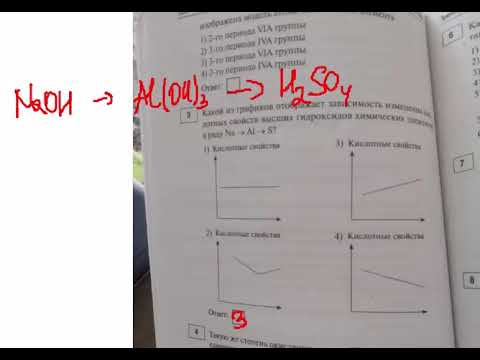 Опыты по химии. Качественные реакции на ионы железа (II) и (III)Скачать  Качественная реакция ионов калия с гидротартратом натрияСкачать  9 класс. Реакции ионного обмена. Ионные уравнения.Скачать  Подготовка к ЕГЭ по химии 2018: задания 30 и 31Скачать  Получение пирофорного железа Щавелевая кислота гидроксид калия железный купорос Желтый осадок Искры!Скачать  Получение гидроксида железа IIIСкачать  Полный разбор варианта ОГЭ | Химия 2023 | УмскулСкачать  |











