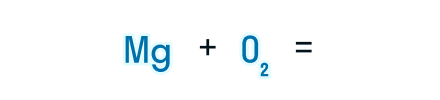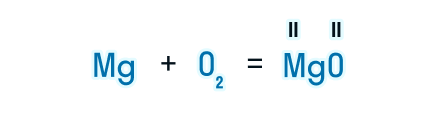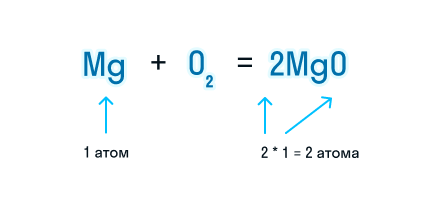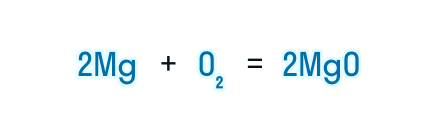Легендарный курс — Предбанник. Повтори весь материал ЕГЭ и ОГЭ за 5-9 дней!
- Задание № 18071
- Натрий: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Химические уравнения
- Алгоритм составления уравнения химической реакции
- Типы химических реакций
- По числу и составу исходных веществ и продуктов реакции
- По изменению степени окисления
- По тепловому эффекту
- По агрегатному состоянию исходных веществ
- По наличию или отсутствию катализатора
- По обратимости
- ВПР 2022 по химии 11 класс 20 вариантов с ответами проверочной работы
- ПОДЕЛИТЬСЯ
- Ответы для заданий с вариантов ВПР:
- 🎥 Видео
Задание № 18071
Взаимодействие натрия с водой относится к реакциям:
3. практически необратимым
1) реакция происходит самопроизвольно, некаталитическая.
2) металл — твердое в-во, вода — жидкость, значит реакция гетерогенная.
3) из сферы реакции улетает образующийся водород, т.е. необратимая.
4) металл меняет степень окисления с 0 до +1, водород восстанавливается с +1 до 0, т.е. происходит окисление и восстановление.
5) 2Na + 2H2O = 2NaOH + H2 — реакция замещения.
Ответ: 34
2 1 9 0 6 1 3
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Натрий: способы получения и химические свойства
Натрий — это щелочной металл, серебристо-белого цвета. Легкий, очень мягкий, низкая температура плавления.
Относительная молекулярная масса Mr = 22,990; относительная плотность по твердому состоянию d = 0,968; относительная плотность по жидкому состоянию d = 0, 27; tпл = 97,83º C; tкип = 886º C.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. Натрий получают в промышленности электролизом расплава гидроксида натрия, в результате образуется натрий, кислород и вода:
4NaOH → 4Na + O2↑ + 2H2O
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Качественная реакция
Качественная реакция на натрий — окрашивание пламени солями натрия в желтый цвет .
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства
Натрий — активный металл; на воздухе реагирует с кислородом и покрывается оксидной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Натрий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Натрий легко реагирует с галогенами с образованием галогенидов:
2Na + I2 = 2NaI
1.2. Натрий реагирует с серой с образованием сульфида натрия:
2Na + S = Na2S
1.3. Натрий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид натрия и гидрид натрия:
3Na + P = Na3P
2Na + H2 = 2NaH
1.4. С азотом натрий реагирует при температуре 100º С и электрическом разряде с образованием нитрида:
1.5. Натрий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом при температуре 250–400º C натрий образует пероксид натрия:
2. Натрий активно взаимодействует со сложными веществами:
2.1. Натрий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и водорода:
2Na 0 + 2 H2 O = 2 Na + OH + H2 0
2.2. Натрий взаимодействует с кислотами . При этом образуются соль и водород.
Например , натрий реагирует с разбавленной соляной кислотой :
2Na + 2HCl = 2NaCl + H2 ↑
2.3. Натрий может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Н атрий может взаимодействовать с гидроксидами:
Например , натрий взаимодействует с гидроксидом натрия при температуре 600º С:
2Na + 2NaOH = 2Na2O + H2
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические уравнения
О чем эта статья:
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
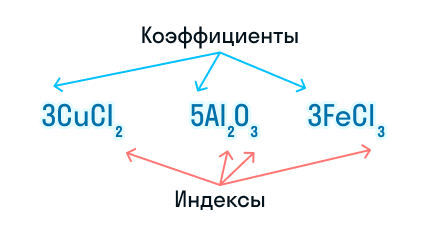
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
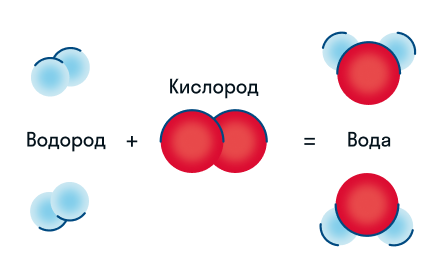
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Видео:Гидролиз солей. 9 класс.Скачать

Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны. Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.
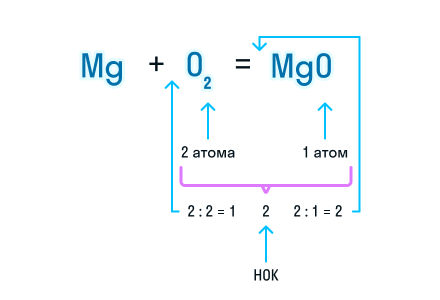
Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
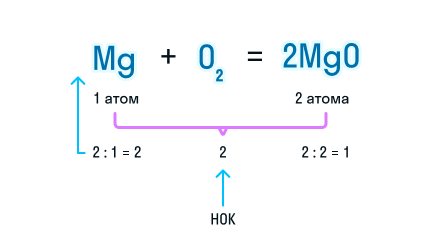
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=». Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.
По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По числу и составу исходных веществ и продуктов реакции
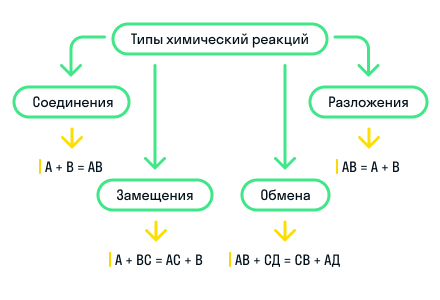
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.
В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Между какими веществами протекает
Между жидкостью и твердым веществом
Сода и уксусная кислота
Между твердым веществом и газом
Между жидким веществом и газом
Между двумя несмешивающимися жидкостями
По наличию или отсутствию катализатора
По этому признаку выделяют реакции каталитические и некаталитические.
Каталитические реакции — реакции, протекающие с участием катализатора
Катализатор — вещество, которое ускоряет реакцию, участвует в ней, но остается неизменным после окончания этой реакции.
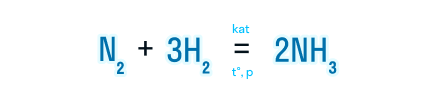
Наличие катализатора указывается над знаком равенства как kat или формула конкретного вещества, выступающего в роли катализатора.
Некаталитические реакции — реакции, протекающие без участия катализатора.
По обратимости
Различают обратимые и необратимые реакции.
Обратимые реакции — реакции, протекающие в двух противоположных направлениях.
При составлении уравнений обратимых реакций вместо знака равенства используют знак «⇄».
К обратимым реакциям относят реакции ионного обмена, диссоциации электролитов и многие другие:
Необратимые реакции — реакции, которые протекают только в одном направлении.
Чтобы научиться составлять уравнения химических реакций, нужно только одно — практика. Много практики школьники получают на онлайн-курсах по химии в Skysmart. Интересные задания на интерактивной платформе, примеры из жизни и опытные преподаватели обязательно приведут к желаемому результату — и просто помогут полюбить химию.
Видео:Химия | Молекулярные и ионные уравненияСкачать

ВПР 2022 по химии 11 класс 20 вариантов с ответами проверочной работы
ПОДЕЛИТЬСЯ
Всероссийская проверочная работа ВПР 2022 по химии для 11 класса 20 вариантов и ответы к ним с решением для подготовки к проверочной работе, которая проходит в школах у 11 класса с 1 по 15 марта 2022 года, также на данном сайте вы можете посмотреть демоверсию ВПР.
Скачать все 20 вариантов и ответы
Ответы для заданий с вариантов ВПР:
1)Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов. Какие из названных способов разделения смесей можно применить для отделения: 1) железных и пластиковых скрепок; 2) воды от заварки чая (листья чая)? Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
2)На рисунке изображена схема распределения электронов по энергетическим уровням атома некоторого химического элемента. На основании предложенной схемы выполните следующие задания: 1) запишите символ химического элемента, которому соответствует данная модель атома; 2) запишите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент; 3) определите, к металлам или неметаллам относится простое вещество, которое образует этот элемент. Ответы запишите в таблицу.
3)Периодическая система химических элементов Д.И. Менделеева – богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений. Так, например, известно, что с увеличением порядкового номера химического элемента основный характер их оксидов в периодах ослабевает, а в группах усиливается. Учитывая эти закономерности, укажите, какой химический элемент среди приведённых образует оксид с наиболее сильными основными свойствами, а какой – с наименьшими: кальций, магний, натрий, калий. В ответе укажите символы этих элементов:
4)В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение. Используя данную информацию, определите, какое строение имеют вещества ацетилен С2Н2 и нитрат аммония NH4NO3.
Правильный ответ: 1) Ацетилен имеет молекулярное строение. 2) Нитрат аммония имеет ионное строение
5)Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из тех, о которых говорится в приведённом выше тексте.
Правильный ответ: Оксид: Na2O или MgО Основание: NaOH или Mg(OH)2 Кислота HСl или H2SO4 Соль: AlCl3 или NaCl
6)Составьте молекулярное уравнение взаимодействия алюминия и соляной кислоты. Укажите тип реакции по её тепловому эффекту.
Правильный ответ: 1) 2Al + 6HCl = 2AlCl3 + 3H2↑ 2) Реакция протекает с выделением теплоты (экзотермическая реакция)
7)Составьте молекулярное уравнение упомянутой в тексте реакции между соляной кислотой и гидроксидом магния. Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
Правильный ответ: 1) Mg(OH)2 + 2HCl = MgCl2 + 2H2O 2) Реакция обмена
8)В составе воды реки Неглинная были обнаружены следующие ионы: NH4 + , Zn2+, Cl– . Для проведения качественного анализа к этой воде добавили раствор AgNO3. 1. Укажите, какое изменение можно наблюдать в растворе при проведении данного опыта, учитывая, что концентрация веществ является достаточной для проведения анализа. Запишите сокращённое ионное уравнение произошедшей химической реакции.
Правильный ответ: 1) Выпадение (белого) осадка 2) Ag+ + Cl– = AgCl↓
9)Дана схема окислительно-восстановительной реакции. MnO2 + HCl → MnCl2 + Cl2 + H2O 1. Составьте электронный баланс этой реакции. Укажите окислитель и восстановитель. Расставьте коэффициенты в уравнении реакции.
Правильный ответ: 1) Составлен электронный баланс: 1 1 Mn+4 + 2ē → Mn+2 2Cl– – 2ē → Cl2 0 2) Указано, что хлор в степени окисления –1 (или HCl) является восстановителем, а марганец в степени окисления +4 (или MnO2) – окислителем; 3) Составлено уравнение реакции: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
10)Дана схема превращений: Fe → FeCl2 → Fe(OH)2 ⎯t° ⎯→ X Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Правильный ответ: 1) Fe + 2HCl = FeCl2 + H2O 2) FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl 3) Fe(OH)2 t° FeO + H2O
11)Из приведённого перечня выберите предельный углеводород и одноатомный спирт. Запишите в таблицу номера, под которыми указаны эти соединения.
Правильный ответ: 53
12)Составьте уравнения реакций: в предложенные схемы химических реакций впишите структурные формулы пропущенных веществ и расставьте коэффициенты.
13)Метилацетат является типичным представителем сложных эфиров. Благодаря низкой токсичности и приятному запаху этот эфир широко используется как растворитель, а также как компонент фруктовых эссенций. В лаборатории метилацетат можно получить в соответствии с приведённой схемой превращений: определите вещество Х, выбрав его из предложенного выше перечня веществ. Запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. Запишите название вещества X. При написании уравнений реакций используйте структурные формулы органических веществ.
14)Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК — это такая концентрация вещества в окружающей среде, которая при повседневном воздействии в течение длительного времени не оказывает прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни. ПДК углекислого газа в воздухе составляет 9 г/м3 . В стеклодувной мастерской площадью 24 м 2 и высотой потолка 2 м 50 см в результате работы газовых горелок в воздухе скопилось 558 г углекислого газа. Определите и подтвердите расчётами, превышает ли концентрация углекислого газа в воздухе данного помещения значение ПДК. Предложите способ, позволяющий снизить концентрацию углекислого газа в помещении.
Правильный ответ: 1) Определён объём помещения и определена концентрация углекислого газа в нём: V (помещения) = 24 ∙ 2,5 = 60 м3 Содержание углекислого газа = 558 г / 60 = 9,3 г/м3 2) Сформулирован вывод о превышении ПДК; Концентрация углекислого газа в помещении превышает показатель 9 г/м3 ; 3) Сформулировано одно предложение по снижению содержания углекислого газа в помещении. Возможные варианты: замена газового оборудования на электрическое; регулярное проветривание (вентиляция) помещения
15)Для приготовления маринадов вместо уксуса можно использовать 2,5%-ный раствор лимонной кислоты. Рассчитайте массу лимонной кислоты и массу воды, которые необходимы для приготовления 160 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса лимонной кислоты: m(кислоты) = 160 ∙ 0,025 = 4 г 2) Рассчитана масса воды: m(воды) = 160 – 4 = 156 г
16)Питьевая сода помогает сохранить свежесть срезанных цветов. Чтобы букет простоял в вазе дольше, в воду добавили 1 чайную ложку (12 г) соды. При этом был получен раствор с массовой долей соды 0,96%. Рассчитайте массу полученного раствора и массу воды, взятой для его приготовления. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса раствора: m(р -ра) = 12 / 0,0096 = 1250 г . 2) Рассчитана масса воды: m(воды) = 1250 – 12 = 1238 г
17)Для приготовления маринада авторы одной из поваренных книг рекомендуют в 1 л воды растворить 35 г соли, 75 г сахара и 25 г уксусной кислоты. Полученный раствор используется при мариновании огурцов, помидоров и других овощей. Рассчитайте массовую долю хлорида натрия и сахарозы в полученном маринаде. Запишите подробное решение задачи.
Правильный ответ: 1) w(NaCl) = 35 / (1000 + 35 + 75 + 25) = 0,031, или 3,1% 2) w(С12Н22О11) = 75 / (1000 + 35 + 75 +25) = 0,066, или 6,6%
18)Для маринования грибов используют маринад с массовой долей соли 7,5%. Рассчитайте массу соли и массу воды, необходимых для приготовления для приготовления 800 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса соли: m(соли) = 800 ∙ 0,075 = 60 г. 2) Рассчитана масса воды: m(воды) = 800 – 60 = 740 г
19)Для приготовления маринадов используют 5%-ный раствор сахара. Для приготовления маринада взяли 2 столовые ложки (50 г) сахара. Рассчитайте, какую массу раствора указанной концентрации при этом получили и какую массу воды использовали для приготовления этого маринада. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса раствора: m(раствора) = 50 ∙ 100 / 5 = 1000 г 2) Рассчитана масса воды: m(воды) = 1000 –50 = 950 г
20)В качестве противогололёдного реагента используют раствор хлорида кальция с массовой долей соли 20%. Рассчитайте массу хлорида кальция и массу воды, необходимых для приготовления 5 кг такого противогололёдного реагента. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса хлорида кальция: m(хлорида кальция) = 5 ∙ 0,2 = 1 кг. 2) Рассчитана масса воды: m(воды) = 5 – 1 = 4 кг
21)При консервировании фруктов плоды заливают сахарным сиропом с массовой долей сахара 40%. Рассчитайте массу сахара и массу воды, которые необходимы для приготовления 1,5 кг такого сиропа. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса сахара: m(сахара) = 1,5 ∙ 0,4 =0,6 кг 2) Рассчитана масса воды: m(воды) = 1,5 – 0,6 = 0,9 кг
22)В медицине в качестве гипертонического раствора используют 20%-ный раствор глюкозы в воде. Рассчитайте массу глюкозы и воды, которые необходимы для приготовления 400 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса растворённого вещества: m(вещества) = 400 ∙ 0,2 = 80 г 2) Рассчитана масса воды в растворе: m(воды) = 400 – 80 = 320 г
23)Для обработки обожжённых кожных покровов применяют 5% раствор перманганата калия. Рассчитайте массы перманганата калия и воды, которые необходимы для приготовления 160 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса растворённого вещества: m(соли) = w(р-ра) ∙ m(р-ра)/100% = 160 ∙ 0,05 = 8 г 2) Рассчитана масса воды в растворе: m(H2O) = m(р-ра) – m(соли)= 160 – 8 = 152 г
24)Для приготовления «золотого сиропа» в 200 г воды растворяют 400 г сахара и добавляют 50 г лимонного сока. Рассчитайте массу приготовленного сиропа и массовую долю сахара в нём. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса сиропа: m(сиропа) = 200 + 400 + 50 = 650 г 2) Рассчитана массовая доля сахара: ω(сахара) = 400 ∙ 100 / 650 = 61,5%
25)Раствор Рингера широко используется в медицине в качестве регулятора водно-солевого баланса, заменителя плазмы и других компонентов крови. Для его приготовления в 1 л дистиллированной воды растворяют 8,6 г хлорида натрия, 0,33 г хлорида кальция и 0,3 г хлорида калия. Рассчитайте массовую долю хлорида натрия и хлорида кальция в полученном растворе. Запишите подробное решение задачи.
Правильный ответ: Рассчитаны массовые доли растворённых веществ: 1) w(NaCl) = 8,6 / (1000 + 8,6 + 0,33 + 0,3) = 0,0085, или 0,85% 2) w(СaCl2) = 0,33 / (1000 + 8,6 + 0,33 + 0,3) = 0,00033, или 0,033%
26)Борный спирт – раствор борной кислоты в этиловом спирте – используют как универсальное дезинфицирующее средство. Рассчитайте массу 5%-ного раствора борной кислоты, которую можно получить из 10 г борной кислоты, и массу спирта, взятого для приготовления этого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса раствора: m(р-ра) = 10 / 0,05 = 200 г 2) Рассчитана масса спирта: m(спирта) = 200 – 10 = 190 г
27)Для приготовления сиропа для консервирования ягод взяли 1 л воды и 250 г сахара. Рассчитайте массу получившегося сиропа и массовую долю сахара в нём. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса сиропа: m(сиропа) = 1000 + 250 = 1250 г 2) Рассчитана массовая доля сахара: ω(сах.) = 250 : 1250 = 0,2, или 20%
28)Для приготовления цукатов 2 кг абрикосов заливают сиропом, приготовленным из сахара массой, равной массе фруктов, и 1 кг воды. Рассчитайте массу приготовленного сиропа и массовую долю сахара в нём. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса сиропа: m(сиропа) = 2 + 1 = 3 кг. 2) Рассчитана массовая доля сахара: ω(сахара) = 2 ∙ 100 / 3 = 66,7%
29)В качестве основы для изготовления глазных капель используют 5%-ный раствор глюкозы. Рассчитайте массу глюкозы и массу воды, которые необходимы для приготовления 180 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса глюкозы: m(глюкозы) = 180 ∙ 0,05 = 9 г 2) Рассчитана масса воды: m(воды) = 180 – 9 = 171 г
30)Для отбеливания древесины используют раствор щавелевой кислоты. Для приготовления раствора смешали 50 кг воды и 3 кг щавелевой кислоты. Рассчитайте, какую массу раствора при этом получили и массовую долю щавелевой кислоты в образовавшемся растворе. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса раствора: m(р-ра) = 50 + 3 = 53 кг 2) Рассчитана массовая доля щавелевой кислоты: ω(щавелевой кислоты) = 3 ∙ 100 / 53 = 5,7%
31)При термических ожогах для промывания ран применяют 5%-ный раствор перманганата калия (марганцовки) в воде. Рассчитайте массу перманганата калия и воды, которые необходимы для приготовления 200 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса растворённого вещества: m(вещества) = 200 ∙ 0,05 = 10 г 2) Рассчитана масса воды в растворе: m(воды) = 200 – 10 = 190 г
32)Для повышения урожайности семена моркови перед посевом рекомендуется обработать 0,2%-ным раствором сульфата цинка. Рассчитайте массу сульфата цинка и массу воды, которые необходимы для приготовления 800 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса растворённого вещества: m(соли) = 800 ∙ 0,002 = 1,6 г 2) Рассчитана масса воды в растворе: m(воды) = 800 – 1,6 = 798,4 г
33)В качестве антидота при отравлениях солями щавелевой кислоты используют раствор хлорида кальция с массовой долей соли 10%. Рассчитайте массу хлорида кальция и массу воды, необходимых для приготовления 350 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса хлорида кальция: m(хлорида кальция) = 350 ∙ 0,1 = 35 г 2) Рассчитана масса воды: m(воды) = 350 – 35 = 315 г
34)Для подкормки растений используют 4%-ный раствор сульфата магния. Рассчитайте, какую массу сульфата магния и какую массу воды надо взять для приготовления 500 г такого раствора. Запишите подробное решение задачи.
Правильный ответ: 1) Рассчитана масса сульфата магния: m(сульфата магния) = 500 ∙ 0,04 = 20 г. 2) Рассчитана масса воды: m(воды) = 500 – 20 = 480 г
🎥 Видео
8 класс. Составление уравнений химических реакций.Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакции ионного обмена. 9 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать