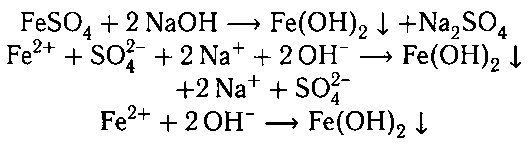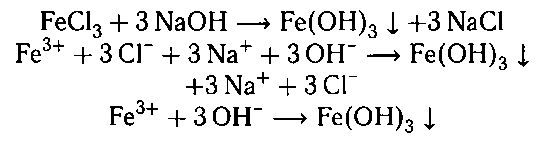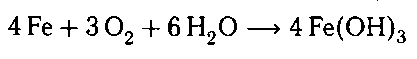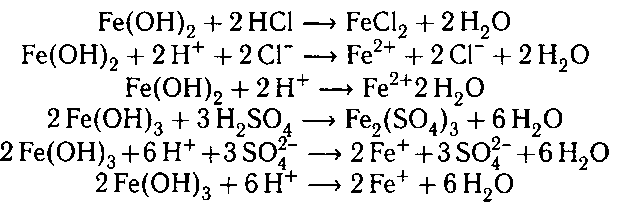1) Составьте молекулярное уравнение реакции гидроксида железа (II) с соляной кислотой, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции.
Прочитайте следующий текст и выполните задания 5—7.
Железо это блестящий, серебристо-белый, мягкий металл, с давних пор широко применяемый человеком. Известно большое количество руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк магнитный железняк
сидерит
мелантерит
вивианит
Свойства соединений железа в значительной степени зависят от степени окисления железа. Так, в степени окисления +2 железо образует оксид
который проявляет основные свойства, ему соответствует гидроксид
Эти соединения способны реагировать с растворами сильных кислот, например с соляной кислотой (
) с образование хлорида железа (II)
Железо один из самых используемых металлов, на него приходится до 95% мирового металлургического производства. Железо является основным компонентом сталей и чугунов важнейших конструкционных материалов.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. Оксид бинарное соединение, в котором один из атомов является кислородом в степени окисления −2. Из предложенных соединений оксидами являются и
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота
4. Соль состоит из иона металла и иона кислотного остатка, примерами являются и
Ответ: Оксид или
или
основание
кислота
соль
или
или
или
Видео:Химия | Молекулярные и ионные уравненияСкачать

Гидроксид железа (II)
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Видео:Получение гидроксида железа (II) и взаимодействие его с кислотамиСкачать

Лабораторные опыты 18 и 19 Химия 9 класс Рудзитис, Фельдман
Кто сделал лабы?
Получение гидроксида железа(II) и взаимодействие его с кислотами.
1. Налейте в пробирку 2—3 мл свежеприготовленного раствора сульфата железа(II) и добавьте немного раствора гидроксида натрия. 2. К полученному осадку добавьте немного соляной кислоты.
Получение гидроксида железа(III) и взаимодействие его с кислотами.
1. Налейте в пробирку 2—3 мл раствора хлорида железа(III) и добавьте немного раствора гидроксида натрия. 2. К полученному осадку добавьте немного серной кислоты.
Задания.
1. Как получают гидроксид железа(II) и гидроксид железа(III)?
2. Какого цвета полученные осадки? 3. Какие вещества образуются при взаимодействии полученных осадков с кислотами? 4. Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде. 5. Как можно определить ионы железа Fе2+ и Fе3+?
Получение гидроксида железа(II) и взаимодействие его с кислотами.
Получение гидроксида железа(III) и взаимодействие его с кислотами.
1. Гидроксид железа (II) получают действием
щелочей на водные растворы солей железа (II):
Гидроксид железа (III) получают взаимодействи-
ем солей железа (III) со щелочами:
Также можно получить взаимодействием чисто-
го железа при нагревании с водой в присутствии
кислорода воздуха:
3. Гидроксид железа (II) зеленого цвета, гид-
роксид железа (III) бурого цвета.
4. При взаимодействии полученных осадков с
кислотами получаются соли железа:
5. Ионы Fe 2+ от Fe 3 + можно отличить по цвету их
гидроксидов: зеленого Fe(OH)2, бурого — Fe(OH)3.
🔥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие железа с соляной кислотойСкачать

Получение гидроксида железа (II)Скачать

Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать

Опыты по химии. Получение гидроксида железа (II) и изучение его свойствСкачать

Химия. Молекулярные и ионные уравненияСкачать

Получение гидроксида железа II и изучение его свойствСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Взаимодействие гидроксида железа (II) | с серной кислотойСкачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

гидроксид железа 2Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение гидроксида железа (II) Fe(OH)2Скачать

Получение гидроксида железа (III) и взаимодействие его с кислотамиСкачать

Опыты по химии. Получение гидроксида железа (III) и изучение его свойствСкачать

Получение гидроксида меди (II) и растворение его в кислотахСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать