Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Угарный газ в промышленности также можно получать неполным окислением метана:
Химические свойства
Оксид углерода (II) – несолеобразующий оксид . За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода . Пламя окрашено в синий цвет:
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
3. Угарный газ взаимодействует с водородом при повышенном давлении . Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например , под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например , угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов .
Например , оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например , пероксидом натрия:
Видео:Уравнивание реакций горения углеводородовСкачать

Составьте молекулярное уравнение реакции гематита с оксидом углерода 2
1) Составьте молекулярное уравнение реакции магнетита с оксидом углерода (II);
2) Укажите, является ли эта реакция окислительно-восстановительной или она протекает без изменения степеней окисления.
Прочитайте следующий текст и выполните задания 5—7.
Металл железо известен человеку ещё с глубокой древности. Использовать изделия из него начали ещё в начале 1-го тысячелетия до н. э. В Древнем Египте железо называли «небесный металл», его древнегреческое название означает «звёздный», а древнеримское переводится как «капнувший с неба». Такое название металла объяснялось очень просто: в древности люди не умели добывать соединения железа и получать из них металл, а использовали только метеоритное железо, то есть буквально железо, упавшее с неба. Широкое использование железа не прекращается и в настоящее время. Известно, что в самородном виде в природе железо практически не встречается, однако его соединения, такие как гематит , магнетит
и пирит, широко распространены. Из этих соединений металл и получают в настоящее время. Один из способов получения железа заключается в восстановлении его оксида под действием оксида углерода (II)
при высокой температуре. В чистом виде железо представляет собой серебристо-серый тугоплавкий металл, обладающий превосходными механическими свойствами: большой прочностью и способностью прокатываться, протягиваться и штамповаться. В основном этот металл используют в виде сплавов — чугуна, стали и др. Взаимодействие железа и оксидов железа с кислотами (например,
) приводит к образованию солей, которые также широко применяются. Так, например хлорид железа (III)
используется при окрашивании тканей, при производстве красящих пигментов, в качестве коагулянта при очистке воды. Сульфат железа (II)
используется при окрашивании ткани и шерсти, в сельском хозяйстве и в медицине. При взаимодействии сульфата железа (II) с гидроксидом натрия
образуется гидроксид железа (II)
. Это соединение используется при изготовлении железо-никелевых аккумуляторов.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота .
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является хлорид железа (III) .
Ответ: Оксид — , основание —
, кислота —
, соль —
.
Возможны также другие варианты ответа для граф «оксид» , «основание»
«кислота»
и «соль»
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

ВПР по химии 11 класс
Всероссийская проверочная работа по химии.
Просмотр содержимого документа
«ВПР по химии 11 класс»
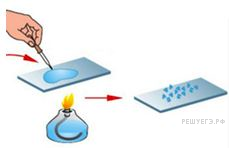
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) смеси железного и алюминиевого порошка;
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Способ разделения смеси
Смеси железного и алюминиевого порошка
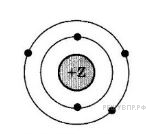
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
1) определите химический элемент, атом которого имеет такое электронное строение;
2) укажите номер периода и номер группы в Периодической системе химических элементов Д. И. Менделеева, в которых расположен этот элемент;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
Ответы запишите в таблицу.
Периодическая система химических элементов Д. И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Например, известно, что с увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах — уменьшается.
Учитывая эти закономерности, расположите в порядке уменьшения электроотрицательности следующие элементы: 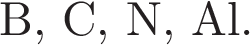
В ответе укажите обозначения элементов разделяя &. Например, 11&22.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние;
— имеют низкие значения температур кипения и плавления;
— имеют низкую теплопроводность
— твёрдые при обычных условиях;
— в расплавах и растворах проводят
Используя данную информацию, определите, какое строение имеют вещества йодоводород 
кальция
Запишите ответ в отведённом месте:
1) йодоводород 
2) карбонат кальция 
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Металл железо известен человеку ещё с глубокой древности. Использовать изделия из него начали ещё в начале 1-го тысячелетия до н. э. В Древнем Египте железо называли «небесный металл», его древнегреческое название означает «звёздный», а древнеримское переводится как «капнувший с неба». Такое название металла объяснялось очень просто: в древности люди не умели добывать соединения железа и получать из них металл, а использовали только метеоритное железо, то есть буквально железо, упавшее с неба. Широкое использование железа не прекращается и в настоящее время. Известно, что в самородном виде в природе железо практически не встречается, однако его соединения, такие как гематит 







1) Составьте молекулярное уравнение реакции железа с кислородом с образованием гематита.
2) Укажите, является ли эта реакция окислительно-восстановительной или она протекает без изменения степеней окисления.
1) Составьте молекулярное уравнение упомянутой в тексте реакции между сульфатом железа (II) и гидроксидом калия.
2) Укажите признак реакции, протекающей между сульфатом железа (II) и гидроксидом калия.
При исследовании минерализации бутилированной воды в ней были обнаружены следующие анионы: , , . Для проведения качественного анализа к этой воде добавили раствор .
1. Какое изменение наблюдается при проведении описанного опыта? (Концентрация веществ достаточна для проведения анализа).
2. Запишите сокращённое ионное уравнение протекающей химической реакции.
Дана схема окислительно-восстановительной реакции:
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице классам/группам органический соединений. Запишите номера этих веществ в соответствующие графы таблицы.
В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого выше перечня, и расставьте коэффициенты.
Изопропиловый спирт благодаря низкой токсичности используется в качестве растворителя в косметике, парфюмерии, бытовой химии, в средствах для очистки стёкол, оргтехники и т. п. Изопропиловый спирт можно получить в соответствии с приведённой схемой превращений:
Выберите из предложенного перечня вещество Х и запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ. Запишите название вещества Х.
Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК — это такая концентрация вредного вещества в окружающей среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК акролеина в воздухе рабочей зоны составляет 0,2 мг/м 3 .
В рабочем помещении одного из ресторанов быстрого питания площадью 32 м 2 и высотой потолка 3,2 м в процессе длительной тепловой обработки жира в воздух выделилось 25,6 мг акролеина. Определите и подтвердите расчётами, превышает ли концентрация акролеина в воздухе данного помещения значение ПДК. Предложите способ, позволяющий снизить концентрацию акролеина в помещении.
Раствор формальдегида зачастую используют в медицине как антисептик. Чему равен объём (н. у.) формальдегида, который потребуется для получения 1 л формалина ( = 1,11 г/мл) с массовой долей формальдегида 10%? (Ответ дайте с точностью до десятых).
🔍 Видео
Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

25. Схема реакции и химическое уравнениеСкачать

Упражнения на составление формул и названий гомологов и изомеров | Химия 10 класс #5 | ИнфоурокСкачать

29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Изомеры, гомологи, органическая химияСкачать

Элементный состав углеводородовСкачать

Реакционная способность и идентификация алканов и циклоалканов. Часть 1.Скачать

Составление уравнений реакций горения. 11 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Решение задач на определение молекулярной формулы органического вещества -три типаСкачать

Метод молекулярных орбиталей. Часть 1. Основные понятия.Скачать
Решение задач на нахождение молекулярной формулы вещества по известной относительной плотности газаСкачать

задача на определение молекулярной формулы органического вещества 1-5Скачать

ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ. ХИМИЯ ЕГЭСкачать

Опыты по химии. Модели молекул метана и других углеводородовСкачать

Окислительно-восстановительные реакции с участием органических веществ. Лекция 1Скачать

Окислительно-восстановительные реакции с участием органических веществ. Лекция 2Скачать