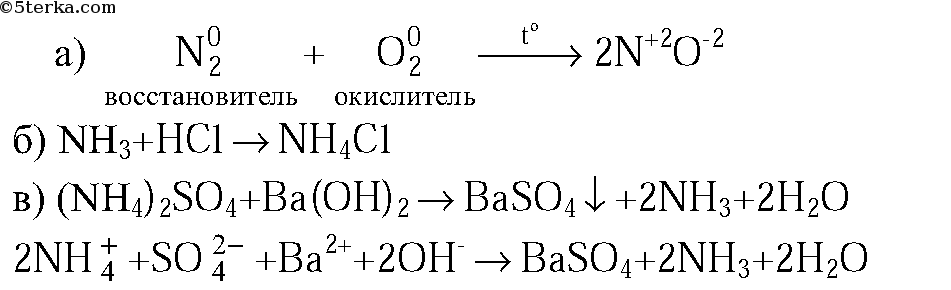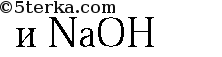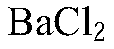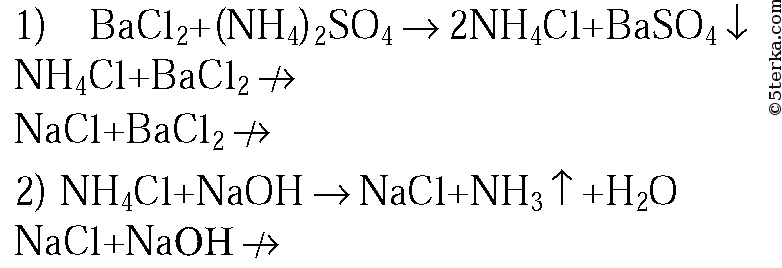Видео:Химия. Молекулярные и ионные уравненияСкачать

Ваш ответ
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

решение вопроса
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Похожие вопросы
- Все категории
- экономические 43,410
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,042
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Вариант 4
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Вопросы:
1. Напишите уравнения реакций: а) азота с кислородом (укажите условия протекания, обозначьте степени окисления элементов и укажите окислитель и восстановитель); б) аммиака с хлороводородом; в) раствора сульфата аммония с раствором гидроксида бария (в молекулярной и ионной формах).
2. В трех пронумерованных пробирках находятся кристаллические вещества: хлорид аммония, сульфат аммония и хлорид натрия. Как их можно распознать? Напишите уравнения соответствующих реакций.
3. Изобразите молекулярную, электронную и структурную формулы аммиака. Перечислите физические свойства аммиака.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Ответы и решения:
2. Данные вещества можно распознать при помощи растворов

задача №4
к главе «Тема III. Подгруппа азота. Работа 1. Азот. Аммиак. Соли аммония».
Видео:Кислородсодержащие соединения азота. Видеоурок 31. Химия 9 классСкачать

Соединения азота с кислородом
Среди элементов 2-го периода азот образует наибольшее число разных оксидов. Все они представляют собой термодинамически неустойчивые вещества, способные разлагаться на азот и кислород или отдавать кислород другим веществам, проявляя окислительные свойства. Физические свойства оксидов азота представлены в табл. 20.2.
Характеристика оксидов азота
Средняя СО азота
Эндотермическая реакция между кислородом и азотом протекает при температуре около 2000°С (см. выше). Выход образующегося оксида азота(П) N0 составляет лишь 2—3%. При охлаждении смеси равновесие смещается в сторону образования простых веществ, т.е. оксид разлагается. Если охлаждение производится быстро, то равновесие сместиться не успевает и образовавшийся N0 сохраняется в смеси, так как скорость разложения падает практически до нуля, так же, как и скорость образования. Реакция между кислородом и азотом в атмосфере происходит только при грозовых разрядах, которые не приводят к ощутимому загрязнению атмосферы оксидами
азота. В крупных городах существенное повышение концентрации N0 и Ж)2 в воздухе происходит от работы автомобильных двигателей. При некоторых метеорологических условиях их концентрация может достигать предельно допустимого значения 1 мг/м 3 . Оксид азота(II) ядовит, но при концентрации порядка 10 -8 моль/л он необходим для поддержания нормального тонуса кровеносных сосудов. Лекарственные препараты типа нитроглицерина образуют оксид азота и способствуют расширению сосудов сердца.
Оксид азота(Н) образуется также при реакциях некоторых металлов с азотной кислотой определенной концентрации. Например, при реакции 10%-ной НЫ03 с медными стружками основным газообразным продуктом является N0:
Наиболее важной реакцией получения N0 в промышленности является каталитическое окисление аммиака (см. далее).
В молекуле N0 шесть электронов находятся на связывающих и один электрон — на разрыхляющей орбитали:
Кратность связи в этой молекуле 2,5. Вследствие того, что неспаренный электрон находится на разрыхляющей орбитали, молекула N0 не проявляет высокой химической активности типичных свободных радикалов.
Оксид азота(П), отдавая кислород, способен поддерживать горение некоторых сильных восстановителей, например, магния:
Наиболее легко идет реакция N0 с кислородом. Смешиваясь с воздухом, бесцветный N0 сразу же образует бурые клубы оксида азота(ТУ):
В молекуле Ж)2 атом азота имеет неспаренный электрон на не связывающей (а не на разрыхляющей) орбитали. Поэтому вещество активно в реакциях соединения. В газообразном состоянии Ы02 ниже 140°С устанавливается равновесие
которое смещается вправо при понижении температуры. По мере увеличения доли димера окраска вещества ослабевает. При 21,3°С газ начинает сжижаться в желтую жидкость, которая при -9,3°С образует бесцветные кристаллы. Исчезновение окраски означает, что твердое вещество состоит только из молекул Ы204. Строение димерных молекул симметричное, 71-связи в них делокализованы:
Атом азота образует четыре полярные ковалентные связи за счет передачи электрона атому кислорода. Расстояние между атомами азота в этой молекуле относительно велико — 164 им (в молекуле гидразина Н2К-ЫН2 оно равно только 146 нм), чем и обусловлены легкость разрыва этой связи и распад димера на две молекулы Ж)2. Мономер и димер оксида азота(1У) можно рассматривать как одно и то же вещество, которое в кристаллическом и жидком состояниях состоит из молекул Ы204, а при испарении часть этих молекул распадается на две молекулы М02.
Молекулы Ж)2 не только соединяются между собой, но при охлаждении реагируют с молекулами N0, образуя оксид азота(Ш) Ы203. Эго неустойчивое вещество, существующее в виде жидкости синего цвета при температуре ниже 3,5°С. Молекула Ы203 не симметричная, со связью между атомами азота:
Очевидно, что атомы азота имеют разные степени окисления: +4 и +2, что и дает среднее значение +3. Как Г^О^, так и Ы203 реагируют с водой, образуя кислоты. Если к атому кислорода в молекуле Ы204 присоединяется протон из молекулы Н20, то под действием положительного заряда электронная пара связи Ы-Ы смещается в направлении этого заряда и связь разрывается. Одновременно на освободившуюся орбиталь атома азота передается электронная пара кислорода из другой молекулы воды. В результате образуются азотистая и азотная кислоты:
Оставшиеся от молекул воды свободные ионы ОН и Н + снова образуют молекулу воды. Молекулярное уравнение реакции запишется гак:
Реакция, идущая по аналогичному механизму между оксидом азота(Ш) и водой, приводит к образованию только азотистой кислоты:
Еще два оксида азота образуются по реакциям, не связанным с непосредственным взаимодействием азота и кислорода. Оксид азота (1) Ы20 вместе с парами воды выделяется при термическом разложении нитрата аммония:
Образующееся газообразное соединение имеет особое название — веселящий газ. При небольшой примеси Ы20 в воздухе наступает состояние возбуждения, которое при большей концентрации Ы20 переходит в обморок. Это вещество применяется в составе смесей для ингаляционного наркоза.
Молекула построена несимметрично, и фактически атомы азота имеют СО 0 и +2:
Растворимость ЖО в воде приблизительно такая же, как у углекислого газа, но в реакцию с водой оксид азота (1) не вступает.
Высший оксид азота(У) Ы205, или азотный ангидрид, получается при обезвоживании дымящей азотной кислоты оксидом фосфора(У). Кислоту но каплям добавляют к порошку Р20=;. Образующийся газообразный Ы205 с потоком кислорода переносится в охлаждаемый сосуд, где образует бесцветные кристаллы с температурой плавления 30°С. Другой способ получения оксида азота(У) заключается в окислении Ы02 озоном.
Молекула Ы205 состоит из двух фрагментов Ж)2, соединенных через атом кислорода.
Оксид азота(У) неустойчив и постепенно разлагается на кислород и Ы02. При 0°С период полураспада равен приблизительно 10 суток, а при 20°С — 10 ч. Оксид азота(У) гигроскопичен — расплывается во влажном воздухе и быстро реагирует с жидкой водой, образуя азотную кислоту:
🔥 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Составление формул соединений. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

8 класс. Составление уравнений химических реакций.Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать