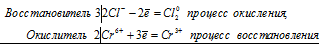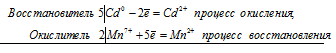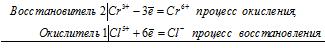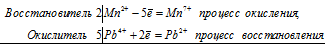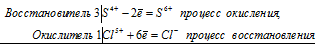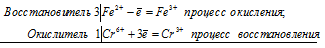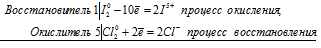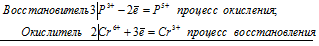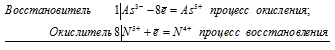- Решение задач на составлении электронных уравнений химических реакций
- Составьте электронный баланс к уравнению реакции по заданию а1 тест 7 вариант 2
- Тестовые задания к параграфу 20
- Тест 20. Окислительно-восстановительные реакции
- Используя метод электронного баланса, расставьте коэффициенты в уравнениях реакций. Определите окислитель и восстановитель
- 1. HI + H2SO4 → I2 + H2S + H2O
- 2. H2SO4 + Cu2O → CuSO4 + SO2 + H2O
- 3. HNO3 + FeO → Fe(NO3)3 + NO + H2O
- 4. H2S + KClO3 → S + KCl + H2O
- 5. KNO3 + Al + KOH + H2O → NH3 + K[Al(OH)4]
- 6. SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
- 7. SO2 + K2Cr2O7 + H2SO4 → K2SO4 +Cr2(SO4)3 +H2O
- 8. NaBr + H2SO4 → Br2 + SO2 +Na2SO4 +H2O
- 9. KI + … + H2SO4 → I2 + … + MnSO4 + H2O
- 10. Fe(OH)2 + KClO + …→ … + Fe2(SO4)3 + H2O
- 11. P + HNO3 + H2O → H3PO4 + NO
- 12. Si + NaOH + H2O → Na2SiO3 + H2
- 13. H2S + Cl2 + H2O → H2SO4 + HCl
- 14. S + HNO2 → H2SO4 + NO + H2O
- 15. FeCl3 + H2S → HCl + S + FeCl2
- 16. Zn + HNO3 → Zn(NO3)2 + NO + H2O
- 17. Zn + H2SO4 (конц.) → ZnSO4 + H2S + H2O
- 18. Cu + HNO3 (разб.) → Cu(NO3)2 + NO + H2O
- 19. Ca3(PO4)2 + SiO2 + C → СaSiO3 + P + CO
- 20. HCl + CrO3 → Cl2 + CrCl3 + H2O
- 21. HCl + KClO3 → Cl2 + KCl + H2O
- 22. KI + KIO3 + H2SO4 → I2 + K2SO4 + H2O
- 23. NO + KOH → KNO2 + N2 + H2O
- 24. Ba(OH)2 + Cl2 → BaCl2 + Ba(ClO3)2 + H2O
- 25. Ag + HClO3 → AgCl + AgClO3 + H2O
- 💥 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Решение задач на составлении электронных уравнений химических реакций
Задание 236.
Реакции выражаются схемами:
HCl + CrO3 ⇔ Cl2 + CrCl3 + H2O;
Cd + KMnO4 + H2SO4 ⇔ CdSO4 + MnSO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а) HCl + CrO 3 ⇔ Cl2 + CrCl 3 + H 2 O
2Cr 6+ + 6Cl — = 2Cr 3+ + 3Cl2 0
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HCl – восстановитель, CrO3 – окислитель; HCl окисляется до Сl2, CrO3 – восстанавливается до CrCl3.
5Сd 0 + 2Mn 7+ = Cd 2+ + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cd – восстановитель, KMnO 4 – окислитель; Cd окисляется до CdSO 4, KMnO 4 – восстанавливается до MnSO 4.
Задание 237.
Реакции выражаются схемами:
Cr2O3 + KClO3 + KOH ⇔ K2CrO4 + KCl + H2O;
MnSO4 + PbO2 + HNO3 ⇔ HMnO4 + Pb(NO3)2 + PbSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Cr 3+ + Cl 5+ = 2Cr 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Cr2O3 – восстановитель, KClO3 – окислитель; Cr2O3 окисляется до K2CrO4, KClO3 – восстанавливается до KCl.
5Pb 4+ + 2Mn 2+ = 5Pb 2+ + 2Mn 7+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 5 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: PbO2 – восстановитель, MnSO4 – окислитель; PbO2 окисляется до Pb(NO3)2, MnSO4 – восстанавливается до HMnO4.
Задание 238.
Реакции выражаются схемами:
H2SO3 + HClO3 ⇔ H2SO4 + HCl;
FeSO4 + K2Cr2O7 + H2SO4 ⇔ Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H2SO3 – восстановитель, HClO3 – окислитель; H2SO3 окисляется до H2SO4, HClO3 – восстанавливается до HCl.
3Fe 2+ + Cr 6+ = 3Fe 3+ + Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов три. Разделив это число на 3, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 3 на 1 получаем коэффициент 3 для восстановителя и продукта его окисления. Учитывая, что в схеме реакции указаны вещества, содержащие железо и хром с двумя атомами в молекулах Fe2(SO4)3 и Cr2(SO4)3], умножим коэффициенты при окислителе и восстановителе на 2, получим молекулярное уравнение реакции:
Задание 239.
Реакции выражаются схемами:
I2 + Cl2 + H2O ⇔ HClO3 + HCl;
K2Cr2O7 + H3PO3 + H2SO4 ⇔ Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
I 2 0 + 5Cl2 0 ⇔ 2I — + 10Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 2, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 10 на 10 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: I2 – восстановитель, Cl2 – окислитель; I2 окисляется до HIO3, Cl2 – восстанавливается до HCl.
3P 3+ + 2Cr 6+ = 3P 5+ + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: H 3PO 3 – восстановитель, K 2Cr 2O 7 – окислитель; H 3PO 3 окисляется до H 3PO 4, K 2Cr 2O 7 – восстанавливается до Cr 2(SO 4) 3.
Задание 240.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВг; б) K2Cr2O7 и Н3PO3; в) HNO3 и Н2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
АsH3 + НNO3 ⇔ Н3AsO4 + NO2 + Н2O
Решение:
а) Степень окисления в РH3 n(Р) = -3 (низшая), в HBr n(Br) = -1 (низшая). Так как и фосфор, и бром находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в K2Cr2O7 n(Сr) = +6 (высшая); в Н3PO3 n(Р) = +5 (высшая). Так как и хром, и фосфор находятся в своей высшей степени окисления, то оба вещества проявляют только окислительные свойства и взаимодействовать друг с другом не могут;
в) в HNO3 n(N) = +5 (высшая); в H2S n(S) = -2 (низшая). Следовательно, взаимодействие этих веществ возможно, причём HNO3 является окислителем, а H2S – восстановителем.
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
As 3- + 8N 5+ = As 5+ + 8N 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 1, получаем коэффициент 8 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Видео:Учимся составлять электронный баланс/овр/8классСкачать

Составьте электронный баланс к уравнению реакции по заданию а1 тест 7 вариант 2
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Определите окислитель и восстановитель.
1) Составлен электронный баланс:
2) Расставлены коэффициенты в уравнении реакции:
3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
Но кислород — тоже меняет свой заряд, можно его вместо йода выписать? Это ошибка?
Кислород остается в степени окисления -2
Почему там — 2 электрона?
потому что два йода.
Используя метод электронного баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель
1) Составим электронный баланс:
2) Определены коэффициенты, и составлено уравнение реакции:
3) Указаны окислитель и восстановитель:
окислитель — восстановитель —
Видео:Задание №20 на ОГЭ по химииСкачать

Тестовые задания к параграфу 20
1. В схеме реакции между оксидом железа (III) и соляной кислотой:
Fe2O3 + HCl → FeCl3 + H2O
перед формулой образующейся соли нужно поставить коэффициент
1) 1; 2) 2; 3) 3; 4) 6.
2. Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и водой равна:
1) 5; 2) 6; 3) 4; 4) 3.
А теперь расставим коэффициенты:
В уравнении у нас следующие коэффициенты – 1 перед оксидом фосфора (V), 3 перед водой и 2 перед фосфорной кислотой. Таким образом, сумма коэффициентов будет равна 1 + 2 + 3 = 6.
Видео:Решаем 3 вариант из сборника ФИПИСкачать

Тест 20. Окислительно-восстановительные реакции
Используя метод электронного баланса, расставьте коэффициенты в уравнениях реакций. Определите окислитель и восстановитель
1. HI + H2SO4 → I2 + H2S + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
2. H2SO4 + Cu2O → CuSO4 + SO2 + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать окислитель и восстановитель:
Cu2O (Cu + ) — восстановитель
3. HNO3 + FeO → Fe(NO3)3 + NO + H2O
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
HNO3 (N +5 ) — окислитель
FeO (Fe +2 ) — восстановитель
4. H2S + KClO3 → S + KCl + H2O
Решение.
1) Составть электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
KClO3 (Cl +5 ) — окислитель
H2S (S -2 ) — восстановитель
5. KNO3 + Al + KOH + H2O → NH3 + K[Al(OH)4]
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
KNO3 (N+5) — окислитель
Al (Al 0 ) — восстановитель
6. SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
KMnO4 (Mn +7 ) — окислитель
SO2 (S +4 ) — восстановитель
7. SO2 + K2Cr2O7 + H2SO4 → K2SO4 +Cr2(SO4)3 +H2O
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты, составить уравнение реакции:
3) Указать окислитель и восстановитель:
SO2 (S +4 ) — восстановитель
8. NaBr + H2SO4 → Br2 + SO2 +Na2SO4 +H2O
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты, составить уравнение реакции:
3) Указать окислитель и восстановитель:
NaBr (Br -1 ) — восстановитель
9. KI + … + H2SO4 → I2 + … + MnSO4 + H2O
Решение.
1) Определить недостающие вещества и записать полное уравнение реакции:
2) Коэффициенты расставить с помощью метода электронного баланса:
3) Йод в степени окисления −1 является восстановителем, а марганец — окислителем.
10. Fe(OH)2 + KClO + …→ … + Fe2(SO4)3 + H2O
Решение.
1) Составить электронный баланс:
2) Определить недостающие вещества и расставить коэффициенты в уравнении реакции:
3) Железо в степени окисления +2 является восстановителем, а хлор в степени окисления +1 — окислителем.
11. P + HNO3 + H2O → H3PO4 + NO
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать окислитель и восстановитьель
HNO3 (N+5) — окислитель
P 0 — восстановитель
12. Si + NaOH + H2O → Na2SiO3 + H2
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать окислитель и восстановитель
H +1 — окислитель
Si 0 — восстановитель
13. H2S + Cl2 + H2O → H2SO4 + HCl
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать окислитель и восстановитель
S -2 — восстановитель
Cl 0 — окислитель
14. S + HNO2 → H2SO4 + NO + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать окислитель и восстановитель
S 0 — восстановитель
N +3 — окислитель
15. FeCl3 + H2S → HCl + S + FeCl2
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что S -2 — восстановитель, а Fe +3 — окислитель
16. Zn + HNO3 → Zn(NO3)2 + NO + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что Zn 0 — восстановитель, а N +5 — окислитель
17. Zn + H2SO4 (конц.) → ZnSO4 + H2S + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что Zn (Zn 0 ) — восстановитель, а H2SO4 (S +6) — окислитель
18. Cu + HNO3 (разб.) → Cu(NO3)2 + NO + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что Сu 0 — восстановитель, а N +5 — окислитель
19. Ca3(PO4)2 + SiO2 + C → СaSiO3 + P + CO
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что С 0 — восстановитель, а P +5 — окислитель
20. HCl + CrO3 → Cl2 + CrCl3 + H2O
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3) Указать, что Cr +6 — окислитель, а Cl -1 — восстановитель;
21. HCl + KClO3 → Cl2 + KCl + H2O
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
окислитель — KClO3 (Cl +5 ) восстановитель — HCl (Cl -1 )
22. KI + KIO3 + H2SO4 → I2 + K2SO4 + H2O
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
окислитель — KIO3 (I +5 ) восстановитель — KI (I -1 )
23. NO + KOH → KNO2 + N2 + H2O
Решение.
1) Составить электронный баланс:
2) Составить уравнение реакции:
3) Указать, что NO ( за счёт азота в степени окисления +2) является и восстановителем, и окислителем;
24. Ba(OH)2 + Cl2 → BaCl2 + Ba(ClO3)2 + H2O
Решение.
1) Составить электронный баланс:
2) Составить уравнение реакции:
3) Указать, что хлор в степени окисления 0 (Сl2 0 ) является и восстановителем, и окислителем
25. Ag + HClO3 → AgCl + AgClO3 + H2O
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3) Указать окислитель и восстановитель:
💥 Видео
ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

ОВР и метод электронного баланса | Химия ОГЭ 2023 | УмскулСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Все об ОВР за 5 часов | Химия ЕГЭ 2023 | УмскулСкачать

Решение упражнений по теме Метод электронного балансаСкачать

Разбираем РЕГИОНАЛЬНЫЙ ПРОБНИК ОТ ФИПИ! | ЕГЭ по химии 2024 | Катя СтрогановаСкачать

Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать

7 класс. Задачи на измерение информацииСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Практика по заданиям второй части | Химия ОГЭ 2022 | УмскулСкачать

Как сдать промбезопасность А1. Основы.Скачать