AlCl3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора хлорида алюминия
- Гидролиз хлорида алюминия (alcl3), уравнения и примеры
- Какие вещества усиливают гидролиз (hydrolysis) хлорида алюминия
- Смешение хлорида алюминия и карбоната натрия
- Гидролиз солей
- Гидролиз солей алюминия — международный студенческий научный вестник (электронный научный журнал)
- ГИДРОЛИЗ СОЛЕЙ АЛЮМИНИЯ
- Библиографическая ссылка
- ПОИСК
- Гидролиз солей
- 📽️ Видео
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
AlCl3 + HOH ⇄ AlOHCl2 + HCl
Полное ионное уравнение
Al 3+ + 3Cl — + HOH ⇄ AlOH 2+ + 2Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Видео:Гидролиз солей. 9 класс.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
AlOHCl2 + HOH ⇄ Al(OH)2Cl + HCl
Полное ионное уравнение
AlOH 2+ + 2Cl — + HOH ⇄ Al(OH)2 + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Третья стадия (ступень) гидролиза
Молекулярное уравнение
Al(OH)2Cl + HOH ⇄ Al(OH)3 + HCl
Полное ионное уравнение
Al(OH)2 + + Cl — + HOH ⇄ Al(OH)3 + H + + Cl —
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Среда и pH раствора хлорида алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидролиз хлорида алюминия (alcl3), уравнения и примеры
Гидролиз солей — это
химическое взаимодействие ионов соли с ионами воды, приводящее к образованию
слабого электролита.
Если рассматривать соль
как продукт нейтрализации основания кислотой, то можно разделить соли на четыре
группы, для каждой из которых гидролиз будет протекать по-своему.
1). Гидролиз не возможен
Соль, образованная сильным основанием и сильной
кислотой (KBr, NaCl, NaNO3), гидролизу
подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается
нейтральной.
- 2). Гидролиз по катиону (в реакцию с водой
вступает только катион) - В соли, образованной слабым основанием и сильной
кислотой (FeCl2, NH4Cl, Al2(SO4)3,
MgSO4) гидролизу подвергается катион: - FeCl2 + HOH Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- FeOH+
+ 2Cl- +Н+ - В результате гидролиза образуется слабый электролит,
ион H+ и другие ионы. - рН раствора 7 (раствор приобретает
щелочную реакцию). - 4). Совместный гидролиз (в реакцию с водой
вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой
(СН3СООNН4, (NН4)2СО3,
Al2S3), гидролизуется и по катиону, и по аниону. В
результате образуются малодиссоциирующие основание и кислота. рН растворов
таких солей зависит от относительной силы кислоты и основания. Мерой силы
кислоты и основания является константа диссоциации соответствующего реактива.
- Реакция среды этих растворов может быть нейтральной,
слабокислой или слабощелочной: - Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
- Гидролиз —
процесс обратимый. - Гидролиз протекает необратимо, если в результате
реакции образуется нерастворимое основание и (или) летучая кислота - Алгоритм
составления уравнений гидролиза солей
| Ход рассуждений | Пример | |||
1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль. Помните! Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой.
| ||||
| 2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли: |
| |||
| 3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды | 2Na+ + CO32- + H+OH- ↔ (HCO3)- + 2Na+ + OH-В продуктах реакции присутствуют ионы ОН-, следовательно, среда щелочнаяpH>7 | |||
| 4. Записываем молекулярное гидролиза | Na2CO3 + HOH ↔ NaHCO3 + NaOH |
На практике с гидролизом учителю приходится
сталкиваться, например при приготовлении растворов гидролизующихся солей
(ацетат свинца, например). Обычная “методика”: в колбу наливается вода,
засыпается соль, взбалтывается. Остается белый осадок.
Добавляем еще воды,
взбалтываем, осадок не исчезает.
Добавляем из чайника горячей воды – осадка
кажется еще больше… А причина в том, что одновременно с растворением идет
гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза –
малорастворимые основные соли.
Все наши дальнейшие действия, разбавление,
нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не
нагревать, не готовить слишком разбавленных растворов, и поскольку главным
образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей,
то есть уксусной.
В других случаях степень гидролиза желательно
увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более
активным, мы его нагреваем – степень гидролиза карбоната натрия при этом
возрастает.
Важную роль играет гидролиз в процессе
обезжелезивания воды методом аэрации. При насыщении воды кислородом,
содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III),
значительно сильнее подвергающегося гидролизу. В результате происходит полный
гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия
в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли
алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый
гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
- Видео
— Эксперимент «Гидролиз солей» - Видео
— Эксперимент «Гидролиз солей, образованных сильным основанием и слабой
кислотой» - Видео
— Эксперимент «Гидролиз солей, образованных слабым основанием и сильной
кислотой» - Видео
— Эксперимент «Гидролиз солей, образованных слабым основанием и слабой
кислотой» - Видео
— Эксперимент «Усиление гидролиза солей при нагревании» - ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Запишите уравнения гидролиза солей и
определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
№2.
Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
№3.
Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора
соли для следующих веществ:
Сульфид Калия — K2S, Бромид
алюминия — AlBr3, Хлорид
лития – LiCl, Фосфат натрия — Na3PO4, Сульфат калия — K2SO4, Хлорид цинка — ZnCl2, Сульфит
натрия — Na2SO3, Cульфат
аммония — (NH4)2SO4, Бромид бария — BaBr2 .
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Какие вещества усиливают гидролиз (hydrolysis) хлорида алюминия
Задача 1065. Добавление каких веществ усилит гидролиз АIСI3: а) H2SO4; б) ZnCl2; в) (NH4)2S; г) Zn? Решение: а) АIСI3 – соль сильной кислоты и слабого основания гидролизуется по катиону:
АIСI3 ⇔ Al3+ + 3Cl−;
Al3+ + H2O ⇔ AlOH2+ + H+
При гидролизе данной соли образуется избыток ионов водорода Н+, поэтому при добавлении к раствору данной соли кислоты H2SO4 создается дополнительный избыток ионов Н+, что, согласно принципу Ле Шателье, приводит к сдвигу равновесия системы влево, т.е. в сторону уменьшения концентрации ионов Н+, гидролиз ослабнет.
б) ZnCl2 – соль сильной кислоты и слабого основания гидролизуется по катиону (Zn2+ + H2O ⇔ ZnOH+ + H+) так же как и АIСI3, поэтому при смешении этих солей в растворе будет наблюдаться увеличение концентрации ионов Н+, что, естественно, согласно принципу Ле Шателье, приводит к сдвигу равновесия системы влево, т.е. в сторону уменьшения концентрации ионов Н+, гидролиз ослабнет.
- в) (NH4)2S – соль слабого основания и слабой кислоты гидролизуется как по катиону, так и по аниону:
- (NH4)2S ⇔ 2NH4+ + S2−;
- 2NH4+ + H2O ⇔ NH4OH + H+;
- S2- + H2O ⇔ HS− + OH−
При гидролизе данной соли образуется избыток как ионов OH− так и ионов Н+, которые связываясь друг с другом образуют молекулы: Н2О (Н+ + OH− ⇔ Н2О). Но, так как K(Н2S) Читайте также: Бериллий и его характеристики
Образующийся избыток воды приводит к разбавлению раствора соли, т. е. к уменьшению концентрации продуктов реакции. Поэтому при смешении растворов солей хлорида алюминия и сульфида аммония будет наблюдаться уменьшение концентраций ионов Н+ и OH−, что, согласно принципу Ле Шателье будет приводить к сдвигу равновесия в системе вправо, в сторону увеличения концентрации ионов Н+ и OH−, т. е.
к усилению гидролиза.
г) Zn в ряду напряжений стоит до водорода, поэтому при добавлении его в раствор хлорида алюминия кроме гидролиза соли дополнительно будет происходить связывание его с ионами водорода (Zn + 2H+ ⇔ Zn2+ + H2↑.
Таким образом, при прибавлении цинка к раствору хлорида алюминия произойдёт связывание ионов Н+ с металлическим цинком, что, согласно принципу Ле Шателье будет приводить к сдвигу равновесия системы вправо, в сторону увеличения ионов Н+, т. е.
будет наблюдаться усиление гидролиза AlCl3.
Смешение хлорида алюминия и карбоната натрия
Задача 1066. Какие продукты образуются при взаимодействии АIСI3 и Na2CO3 в водном растворе: а) А1(OН)3 и СО2; б) А12(СО3)3 и NaС1? Решение: АIСI3 – соль сильной кислоты и слабого основания гидролизуется по катиону:
- АIСI3 ⇔ Al3+ + 3Cl−;
- Al3+ + H2O ⇔ AlOH2+ + H+
- При гидролизе данной соли образуется избыток ионов водорода Н+.
- Na2CO3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
- Na2CO3 ⇔ 2Na+ + CO32-;
- CO32- + H2O ⇔ HCO3− + OH−
При гидролизе данной соли образуется избыток ионов OH−.
При смешении АIСI3 и Na2CO3 произойдёт связывание ионов Н+ и OH− с образованием молекул воды (Н+ + OH− ⇔ Н2О), что будет способствовать взаимному усилению гидролиза обеих солей.
Поэтому гидролиз АIСI3 и Na2CO3 будет протекать до конца. Значит при смешении АIСI3 и Na2CO3 образуется не А12(СО3)3, а Al(OH)3 и будет выделяться СО2: 2 Al3+ + 3 CO32- + H2O ⇔ 2Al(OH)3↓ + 3СО2↑ Ответ: а).
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидролиз солей
| Цели. Образовательная – сформировать представление о гидролизе; развивающая – развивать умения писать полные ионные уравнения, определять среду растворов, устанавливать образование кислых или основных солей в реакциях; воспитательная – научить самостоятельно оценивать наблюдаемые явления, развивать познавательный интерес. Тип урока. Урок совершенствования знаний, умений, навыков. Методы: обучения – эвристический, преподавания – сообщающий, учения – частично-поисковый, исполнительский. Оборудование и реактивы. Таблицы «Окраска индикаторов», «Степень диссоциации кислот и щелочей», «Растворимость солей, кислот и оснований в воде»; подсветка для пробирок; на столах учащихся: растворы солей NaCl, АlCl3 и Nа2СО3, индикаторы. Планируемые результаты обучения. На изученных примерах уметь объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и образование кислых или основных солей в этом процессе. Знать о практическом значении гидролиза.Уметь экспериментально подтверждать гидролиз соли слабого основания и сильной кислоты и соли сильного основания и слабой кислоты. |
ХОД УРОКА
Гидролиз (от греч. hydro – вода, lysis – разложение) означает разложение вещества водой. Гидролизом соли называют обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита. Вода хотя и в малой степени, но диссоциирует:
Когда концентрации ионов H+ и гидроксид-ионов OH– равны между собой, [H+] = [OH–], то среда нейтральная, если [H+] > [OH–] – среда кислая, если [Н+] Читайте также: Молярная масса газа, формула и примеры
Реакция по третьей ступени практически не протекает. Ввиду накопления ионов водорода процесс смещается в сторону исходных веществ. Однако разбавление раствора и повышение температуры усиливают гидролиз. Поэтому может происходить гидролиз и по третьей ступени (здесь приведена запись только в молекулярной форме):
- Al(OH)2Cl + H2O Al(OH)3 + HCl.
- Итак, в растворе [Н+] > [ОН–].
- В том, что степень гидролиза зависит от условий протекания реакций, убедимся на опыте: получим коллоидный раствор гидроксида железа(III).
Лабораторный опыт № 2. В горячую воду прильем по каплям немного раствора хлорида железа(III). Нерастворимый в воде гидроксид железа(III) не выпадает в осадок, а образует прозрачный коллоидный раствор темно-коричневого цвета:
- При комнатной температуре гидролиз незначительный, останавливается на первой стадии:
- а) Fe3+ + Н2О = Fе(ОН)2+ + Н+.
- При нагревании раствора FeCl3 становится возможным гидролиз по второй ступени:
- Когда мы вливаем раствор FeCl3 в горячую воду, она становится бурой, происходит гидролиз по третьей ступени:
Еще легче подвергаются гидролизу соли, образованные слабой кислотой и слабым основанием, ионы этой соли одновременно связывают ионы Н+ и ОН–, смещая равновесие диссоциации воды. Процесс такого гидролиза часто необратимый, как в случае Аl2S3:
Аl2S3 + 6Н2О = 2Аl(ОН)3 + 3H2S.
Сульфиды хрома, алюминия и их карбонаты не могут существовать в водных растворах, т.к. подвергаются полному гидролизу, соль разлагается (см. таблицу растворимости).
В этом случае реакция раствора зависит от степени диссоциации продуктов гидролиза – кислоты и основания, если [Н+] > [ОН–], то среда кислая, а если [Н+] https://him.1sept.ru/article.php?ID=200400810
Видео:11 класс. Гидролиз солей.Скачать

Гидролиз солей алюминия — международный студенческий научный вестник (электронный научный журнал)
ГИДРОЛИЗ СОЛЕЙ АЛЮМИНИЯ
1 Гуззитаева М.Ф. 1 Неёлова О.В. 1 1 Северо-Осетинский государственный университет им. К.Л. Хетагурова
1. Ахметов Н.С. Лабораторные и семинарские занятия по общей и неорганической химии. – М.: Высшая школа, 2003. – 344 с.
Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк.
Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4, а соли очень слабых кислот, например, Н2СО3, Н2S вообще не образуются осаждением из водного раствора.
Целью работы является: изучение литературных данных по гидролизу солей алюминия, расчет величины рН в растворах AlCl3, приготовление 1, 0,1, 0,01 М растворов AlCl3 и экспериментальное измерение величины рН с помощью рН-метра.
Экспериментально были приготовлены водные растворы хлорида алюминия из кристаллогидрата AlCl3∙6H2O с молярной концентрацией 1, 0,1 и 0,01 моль/л. С помощью универсальной индикаторной бумаги и рН-метра-милливольтметра измерена величина рН в этих растворах. Теоретически рассчитана величина рН в растворах AlCl3 по формулам:
рН = -lg [H+]; [H+] = √kг ∙ ссоли;
k г = kн2о / k3 осн ; k3 осн(Al(OH)3) = 1,38∙10-9 [1].
Проведена сравнительная оценка теоретически вычисленных и экспериментально измеренных значений величины рН. Результаты расчетов и измерений приведены в таблице.
Теоретически вычисленные и экспериментально измеренные величины рН в растворах AlCl3
| Концентрация раствора AlCl3, моль/л | Теоретическое значение рН | Практическое значение рН |
| 1 | 2,57 | 2,51 |
| 0,1 | 3,07 | 3,12 |
| 0,01 | 3,57 | 3,50 |
Как видно из приведенных данных, результаты расчетов и измерений величины рН хорошо коррелируют между собой.
Библиографическая ссылка
Гуззитаева М.Ф., Неёлова О.В. ГИДРОЛИЗ СОЛЕЙ АЛЮМИНИЯ // Международный студенческий научный вестник. – 2015. – № 3-4.;
URL: http://eduherald.ru/ru/article/view?id=14189 (дата обращения: 01.04.2020).
Видео:Составление уравнений реакций горения. 11 класс.Скачать

ПОИСК
ГИДРОЛИЗ ХЛОРИДА АЛЮМИНИЯ [c.108]
Гидролиз хлорида алюминия [c.213]
Уравнения гидролиза хлорида алюминия [c.83]
Опыт 13. Гидролиз хлорида алюминия [c.176]
Гидролиз хлорида алюминия в присутствии сульфида аммония [c.213]
Сульфид натрия усиливает гидролиз хлорида алюминия и доводит его до конца, до А1(0Н)д. В свою очередь, хлорид алюминия усиливает гидролиз сульфида натрия и доводит его до конца, до H2S [c.226]
Напишите схему мицеллы гидроксида алюминия, образующегося по реакции гидролиза хлорида алюминия [c.61]
Гидролиз хлорида алюминия в присутствии соды [c.213]
Запись данных опыта. Написать уравнение реакции гидролиза хлорида алюминия в присутствии сульфида аммония. Почему в данном случае гидролиз протекает до конца Произойдет ли в растворе та же реакция, если вместо сульфида аммония добавить сульфид натрия [c.213]
Разработаны кислотные составы, основанные на применении хлорида алюминия [217, 218]. Гидролиз хлорида алюминия сопровождается генерированием соляной кислоты. Регулировать скорость гидролиза и глубину проникновения состава в пласт предлагается добавками соляной кислоты и хлорида кальция. [c.37]
Существует мнение, что в начальной стадии ионы карбония образуются за счет следов влаги, вызывающих гидролиз хлорида алюминия, и последующего взаимодействия образующегося при этом комплекса с олефинами. Взаимодействие иона карбо- [c.89]
Примечание. Получив хлорид алюминия, можно показать его гидролиз. Хлорид алюминия после охлаждения трубки ссыпать медленно в стакан с водой. Слышно шипение — хлорид алюминия гидролизуется со значительным выделением теплоты. Метиловый оранжевый сообщает раствору розовую окраску. [c.97]
Золь гидроокиси алюминия, образующийся при гидролизе солей алюминия, заряжен положительно при низких значениях pH воды и отрицательно — при высоких.
Поверхность коллоидной частицы золя заряжается в результате нескольких возможных процессов в щелочной среде кристаллическая рещетка частицы достраивается за счет гидроксильных ионов, находящихся в воде, приобретая отрицательный заряд.
В нейтральной и кислой средах возникает положительный заряд вследствие адсорбции решеткой ионов А1 . Строение мицеллы золя при гидролизе хлорида алюминия в нейтральной среде представлено ниже [c.134]
С помощью каких факторов можно сместить равновесие вправо для реакции гидролиза хлорида алюминия [c.92]
Формула мицеллы золя, образующегося при гидролизе хлорида алюминня, имеет следующий вид [c.40]
Реакционную смесь разлагают водой. В результате происходит гидролиз хлорида алюминия и частичная отгонка продуктов реакции [c.233]
Степень гидролиза во многих случаях зависит от pH среды и от разбавления раствора. Гидролиз солей многоосновных кислот, а также солей с многовалентными катионами идет ступенями, большей частью останавливаясь на первой ступени, причем образуются кислые или основные соли. Например, гидролиз хлорида алюминия при комнатной температуре в растворе с невысокой концентрацией идет по уравнению [c.153]
Реакцию обычно проводят при —15°С в присутствии катализатора— порошкообразного безводного хлорида алюминия. Исходные газообразные вещества (хлористый водород и этилен) следует тщательно осушать, так как влага гидролизует хлорид алюминия, что увеличивает расход катализатора и вызывает коррозию аппаратуры. [c.34]
С помощью каких факторов можно уменьшить степень гидролиза хлорида алюминия [c.92]
Хлористый водород может образоваться вследствие гидролиза хлорида алюминия под действием влаги, находящейся в хлористом метиле и поглощенной хлоридом алюминия при контакте с воздухом.
При наличии хлористого водорода в растворе катализатора полимеризация при контакте катализатора с шихтой начинается очень энергично с образованием частиц полимера, склонных к агломерации. С повышением содержания хлористого водорода в полимеризационной системе резко снижается молекулярная масса образующегося полимера.
На рис. 7 приведена зависимость молекулярной массы бутилкаучука от отношения НС1 А1С1з в растворе катализатора. [c.346]
В двухгорлую круглодонную колбу вместимостью 100 мл, снабженную капельной воронкой и обратным холодильником с хлоркальциевой трубкой, вносят 25 мл безводного бензола и 2,5 г тщательно измельченного безводного хлорида алюминия.
(Все операции с хлоридом алюминия на открытом воздухе проводят как можно быстрее из-за его большой гигроскопичности). Хлоркальциевую трубку соединяют резиновым шлангом с воронкой, опрокинутой над водой. В колбу по каплям добавляют 6 мл хлористого бензила (под тягой ).
После прекращения выделения хлористого водорода (обнаруживается по лакмусовой бумаге) в колбу вносят 40 г толченого льда и 5 мл концентрированной соляной кислоты, которая добавляется для предотвращения гидролиза хлорида алюминия.
Затем реакционную смесь переносят в делительную воронку, отделяют бензольный слой, который промывают водой, раствором гидроксида натрия и снова водой. Промытый бензольный раствор [c.91]
Составьте уравнения гидролиза хлорида алюминия сульфита калияз ацетата натрия. [c.82]
Прн гидролизе солей алюминия существенным моментом является диме-ризация, повторение которой наряду с углублением гидролиза приводит к образованию осадка.
Димеры [(Н20) А10Н]2 + образуются из гидролизованных ионов [(Н20)5А10]2+ [12]. Степень гидролиза солей алюминия зависит от их концентрации и температуры среды.
Данные о влиянии этих факторол на процесс гидролиза хлорида алюминия приведены в табл. 11-1. [c.18]
Другой пример — гидролиз хлорида алюминия, который при диссоциации в водном растворе дает гидратированные катион алюминия и хлорид-ион. Хлорид-ион — непротолит, а гидратированный катион алюминия А1 -Н20 в водном растворе проявляет свойства кислоты [c.44]
Уменьшение поглощения ультразвука после максимума (рис. 55, а, б) объясняется образованием сверхмицеллярных агрегатов в процессе коагуляции гидроокисей, выделяющихся в результате гидролиза. Это явление связано с некоторой дегидратацией частиц вследствие снятия электростатического состояния межфазной поверхности и расклинивающего эффекта.
Последующее возрастание коэффициента поглощения ультразвука при добавлении новых порций гидролизующихся солей обусловлено определенной иммобилизацией воды в структурах сверхмицеллярных агрегатов, образующихся при коагуляции гидроокисей.
Особенно заметно такое явление в системе, возникающей при гидролизе хлорида алюминия, где поглощение ультразвука значительно выше, чем в исходных растворах. [c.138]
Идентифицировано несколько десятков продуктов гидролиза хлорида алюмини.я [76, 80—82). Одиако к реально выделенным в твердом виде растворимым основным солям относятся соединения состава Al2(0H)s l, AI ,(0H)8( 1 и А ,,04(0Н),4С17 [83, 84]. [c.90]
О других растворимых основных солях, которые могут образовываться в качестве промежуточных продук тов при гидролизе хлорида алюминия см. Kohls hutter, Z. anorg. ehem., 248, 319, 1941. [c.400]
Конденсат хлоридов, полученный при хлорировании редкоэле-ментпого сырья (лопарит, пирохлор и др.), подвергается гидролизу в 1 %-ном растворе соляной кислоты.
При гидролизе хлориды алюминия, железа и редкоземельных металлов переходят в раствор, а хлориды ниобия, тантала и титана осаждаются из раствора в виде гидроокисей. Гидроокиси металлов после промыки сушатся и прокаливаются.
Гидроокиси сорбируют из раствора различные катионы, в результате чего получаемый продукт имеет разный химический состав и, следовательно, разные физические свойства. [c.206]
Во влажном воздухе также идет гидролиз хлорида алюминия На поверхности хлорида алюминия вначале образуется слой кри сталлогидрата, постепенно кристаллогидратная вода диффундиру ет вглубь и способствует гидролизу новых молекул хлорида алю миния. Возможно, что эти процессы протекают одновременно [c.145]
Вследствие увеличения парциального давления паров хлористого во.дорода во внутренних слоях дальнейший гидролиз хлорида алюминия задерживается [6]. Если гидролиз хлорида алюминия происходит под действием перегретого водяного пара при 280 °С, образуется хлорокись алюминия (А10С1) [7]. [c.146]
Видео:Ступенчатый гидролиз по катиону. Слабое основание + сильная кислотаСкачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
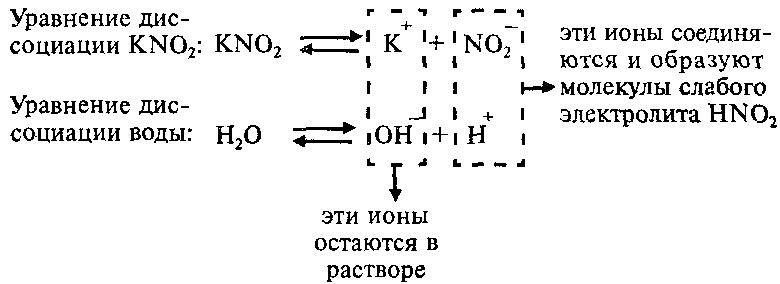
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
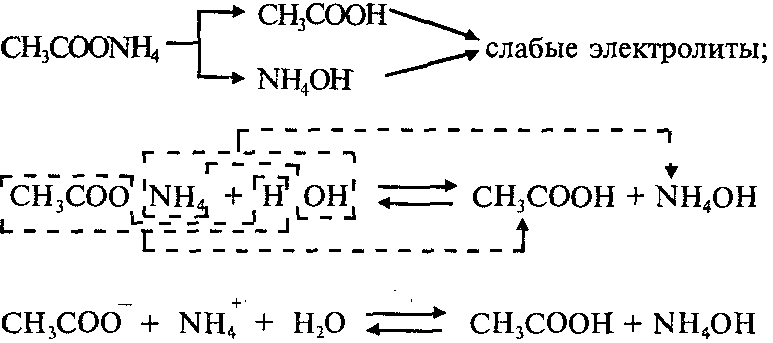
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
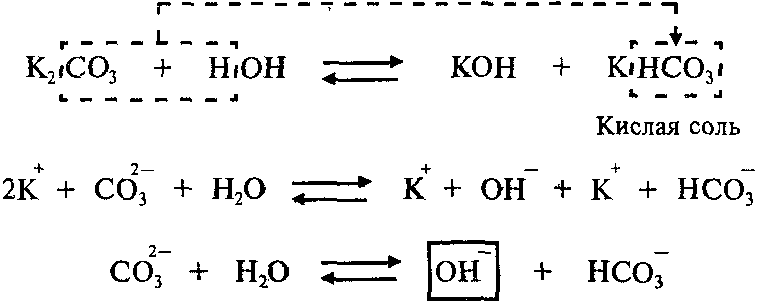
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
📽️ Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Гидролиз без уравнений реакций #химия #химияскатей #гидролиз #егэхимия #химияегэ #огэхимия #химияогэСкачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать

Необратимый гидролиз. Примеры уравнений с объяснением.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Составление уравнений реакций. 1 часть. 8 класс.Скачать