Видео:Получение оксида марганца VII. Химический опытСкачать

MnO2 + H2  MnO + H2O
MnO + H2O
Реакция взаимодействия оксида марганца(IV) и водорода с образованием оксида марганца(II) и воды. Реакция протекает при температуре 170-800°C. [8]
После растирания в порошок оксида марганца(IV), проводят восстановление чистым, полностью свободным от кислорода водородом в течение 4 ч при 800°С. Процесс восстановления идет с заметной скоростью уже при 450°С. При более продолжительном нагревании или при более высокой температуре в продукте появляются серые вкрапления, а затем он становится светло-серым. В присутствии кислорода образуются коричневые препараты. [5]
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Примеры ОВР соединений марганца
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
ОВР соединений марганца
Рассмотрим окислительно – восстановительные свойства соединений марганца, проявляемые ими в разных условиях (в кислотной, нейтральной или щелочной). При проведении ОВР для создания в растворе кислотной среды обычно используют серную кислоту . Азотную кислоту используют крайне редко, так как она сама является сильным окислителем; соляную, бромоводородную и йодоводородную кислоты не используют из-за их способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов натрия или калия.
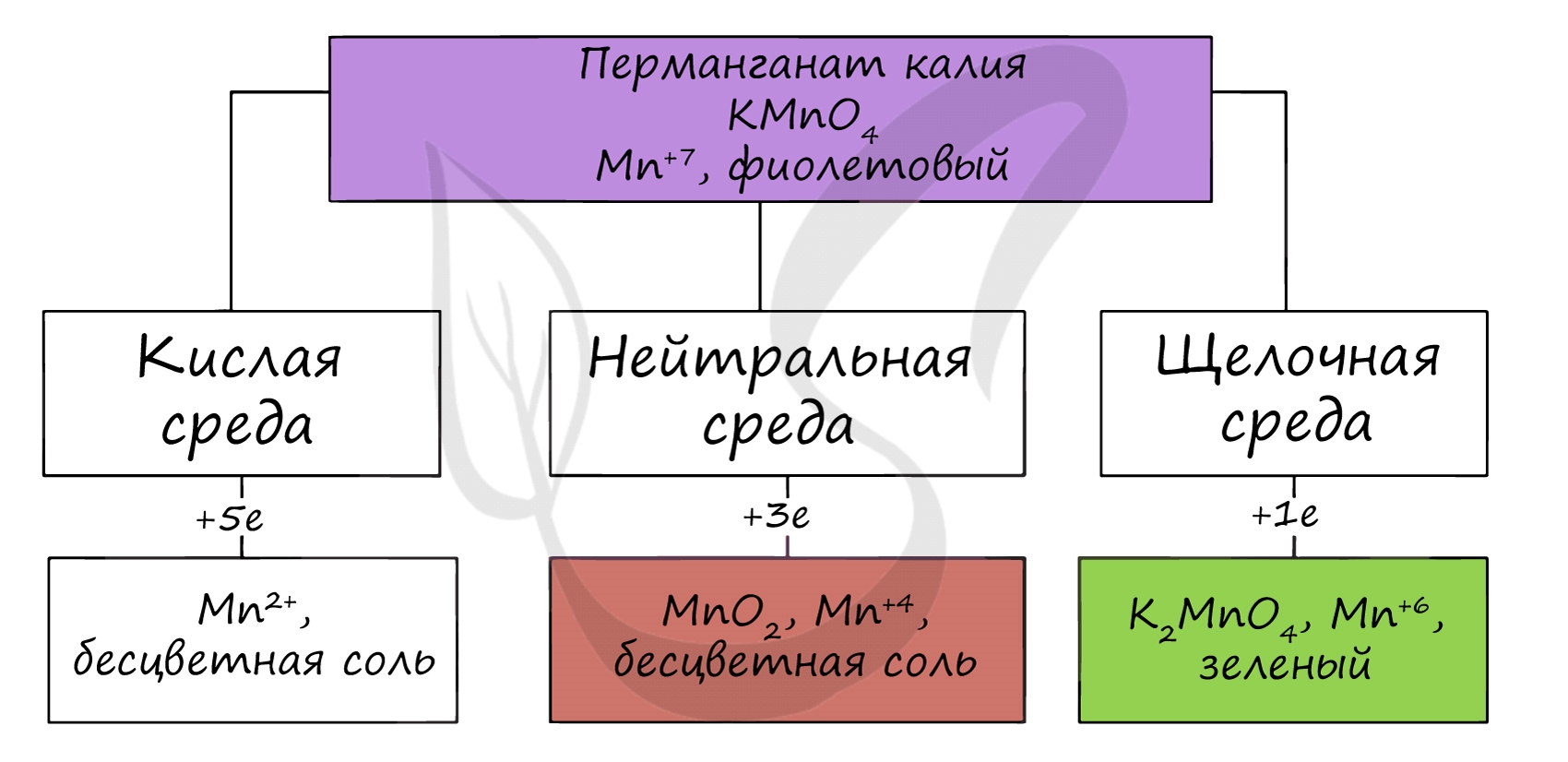
Перманганат калия К MnO 4 всегда является окислителем. Продукты восстановления зависят от характера среды:
Условия протекания окислительно-восстановительных превращений для соединений марганца можно представить в виде схемы, приведенной на рисунке 2.
Как видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав самого популярного в лабораторной практике окислителя, KMnO 4 , в различных средах восстанавливается по-разному. В наибольшей степени окислительные свойства перманганат калия проявляет в кислотной среде, в несколько меньшей – в нейтральной и в наименьшей степени – в щелочной.
Рассмотрим эти случаи на конкретных примерах.
Пример 1. Составьте уравнение реакции, протекающей при пропускании оксида серы ( IV ) через подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения воспользуемся методом электронного баланса.
При составлении уравнений ОВР наличием в растворе гидросульфатных ионов обычно пренебрегают. (Наличием ионов HSO 4 — нельзя пренебрегать при составлении уравнений ОВР типа взаимодействия концентрированной H 2 SO 4 с NaBr (среди прочего образуется NaHSO 4 ), но уравнения этих реакций составляют, используя метод электронного балланса.)
2. После умножения каждого из уравнений полуреакций на соответствующие множители, сложения уравнений и приведения подобных членов получаем ионное уравнение.
2MnO 4 — + 16 Н + + 5SO 2 + 10H 2 O = 2Mn 2+ + 5SO 4 2- + 20 H + + 8H 2 O
3. Добавив в левой части уравнения необходимое количество противоионов и не забывая о них при написании формул продуктов реакции, запишем молекулярное уравнение:
Из уравнения видно, что серная кислота, которая по смыслу задания должна была вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в процессе реакции выделяется, то есть добавлена в раствор только как средообразователь . Но это скорее исключение, чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции, протекающей при сливании раствора перманганата калия с раствором аммиака.
1 . Аммиак – слабое основание, поэтому среда в его водном растворе слабощелочная. Перманганат-ион в этих условиях при восстановлении превращается в диоксид марганца, выпадающий из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало ионов оксония, поэтому для связывания «лишних» атомов кислорода могут быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один атом кислорода, превращается в два гидроксид-иона. Аммиак в этих условиях окисляется до азота (ближайшая устойчивая степень окисления – ноль).
2. Ионное уравнение:
2MnO 4 — + 10H 2 O + 2NH 3 = 2MnO 2 + 8OH — + N 2 
3. Так как в одной из полуреакций образуются гидроксид-ионы, а в другой – ионы водорода, что вполне допустимо в нейтральной (или близкой к ней) среде, перед приведением подобных членов в ионном уравнении необходимо учесть, что эти ионы одновременно в водном растворе существовать не могут (пройдет реакция нейтрализации).
После приведения подобных членов получаем ионное уравнение:
2MnO 4 — + 2NH 3 = 2MnO 2 + 2OH — + N 2 
4. Запишем молекулярное уравнение:
2 KMnO 4 + 2 NH 3 = 2 MnO 2 + 2 KOH + N 2 
Пример 3. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита калия в присутствии гидроксида калия.
Пример 4. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия в присутствии серной кислоты.
Пример 5. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
📽️ Видео
РАЗБИРАЕМ ВСЕ ОВР С МАРГАНЦЕМ ЗА 99 минут!Скачать

СОЕДИНЕНИЯ МАРГАНЦА IV и VII | Таисия Фламель | ВебиумСкачать

Химические свойства марганца. Часть 1.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Химические свойства марганца. Часть 2.Скачать
Составление реакций | ЕГЭ ХИМИЯ | Онлайн-школа СОТКАСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Все об ОВР за 5 часов | Химия ЕГЭ 2023 | УмскулСкачать

Все реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать

Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

МАРАФОН ПО ХИМИИ | ОВР С СОЕДИНЕНИЯМИ МАРГАНЦА | ХИМИЯ ЕГЭ 2023| ТОПСКУЛСкачать

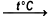 MnO + H2O
MnO + H2O